ВЕЩЕСТВ РАЗЛИЧНОЙ ПРИРОДЫ
До настоящего времени нет теории, с помощью которой можно предсказывать и вычислять растворимость. Это объясняется сложностью взаимодействия частиц в растворе, а также отсутствием общей теории жидкого состояния. Тем не менее многие наблюдаемые зависимости, связанные с растворимостью, можно объяснить.
Известно, что силы, действующие между ковалентными молекулами, обычно неспецифичны и для малополярных молекул невелики. В смеси двух жидкостей А и В, состоящих из молекул с малополярными ковалентными связями, энергия взаимодействия частиц А и В существенно не отличается от энергии взаимодействия между частицами А и А или частицами В и В. Поэтому различные жидкие вещества с ковалентной связью в молекулах обычно неограниченно растворяются друг в друге. По этой же причине молекулярные кристаллы также хорошо растворяются в таких жидкостях. Например, растворимость толуола в бензоле не ограничена, а кристаллический нафталин хорошо растворим в неполярных жидкостях.
Из сказанного становится понятной справедливость старинного, найденного из многовекового опыта правила: «подобное растворяется в подобном». Наоборот, если энергия взаимодействия молекул А и А или В и В больше, чем, А и В, то одинаковые молекулы одного и того же компонента будут связываться между собой и растворимость А в В понизится. Это часто наблюдается при значительной полярности одного из компонентов раствора, например, полярный хлороводород мало растворим в неполярном бензоле. Этим же объясняется небольшая растворимость неполярных и малополярных веществ в полярном растворителе, например, в воде. Молекулы Н2O в жидкой воде связаны друг с другом сильными водородными связями, поэтому притяжение неполярных молекул к молекулам воды меньше, чем притяжение молекул воды друг к другу.
Очень высокая растворимость веществ часто обусловлена образованием с растворителем водородных или донорно-акцепторных связей. Например, водородные связи образуются при растворении этилового спирта в воде, а донорно-акцепторные связи – при растворении AgCl в жидком аммиаке (практически не растворимый в воде AgCl хорошо растворим в жидком аммиаке).
Растворимость солей в воде определяется разностью между энергией кристаллической решетки соли и энергией гидратации ионов. Это малая разность двух больших величин пока не может быть рассчитана теоретически с хорошей точностью. Так, почти все соли щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы нитраты, галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей, а также их гидроксидов.
Для сходных веществ (например, для малополярных газов) растворимость обычно закономерно уменьшается с увеличением эндотермичности теплового эффекта процесса растворения (рис. 2).
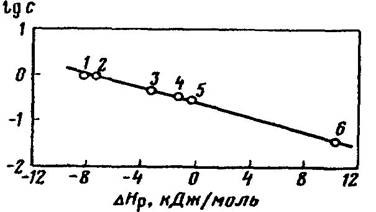
Рис. 2. Взаимосвязь между теплотой растворения ∆Hр и растворимостью газов с в C2H5OH при 25°С: 1 -Не; 2 - Ne; 3 - N2; 4 -СО; 5 - Ar; 6 -СO2
Влияние на растворимость посторонних веществ. В присутствии примесей растворимость данного вещества обычно уменьшается. Так, растворимость газов в воде часто сильно уменьшается при внесении в воду солей или других растворимых в ней веществ. Например, в 1 г воды при 20°С растворяется ≈ 3 см3 хлора, а в 1 г насыщенного раствора NaCl растворяется всего 0,3 см3 хлора (поэтому хлор хранят над водным раствором соли).
Растворимость многих жидкостей понижается в присутствии солей. Например, растворимость фенола в чистой воде больше, чем в солевом растворе. Эффект понижения растворимости в присутствии солей называется высаливанием. Одной из причин высаливания может быть сольватация солей, вызывающая уменьшение числа свободных молекул растворителя, а значит, и понижение растворяющей способности жидкости.
На растворимость электролитов очень сильно влияют добавки веществ, содержащих одноименные ионы.






