Потенціометричний метод ґрунтується на визначенні електрорушійної сили гальванічного елемента, що складається з індикаторного електрода та електрода порівняння, в залежності від концентрації у розчині електроліту (активності у розчині електроліту) досліджуваного йона.

Рис.5. Електродна система для визначення активності йонів у досліджуваному розчині:
А – індикаторний електрод; Б – електрод порівняння
| 1 – кулька із йонселективного скла; 2 – розчин 0,1 М НСl; 3 – хлорований срібний дріт; 4 – скляний балон; 5 – вивідний контакт індикаторного електрода | 1 – скляний корпус; 2, 7– азбестова нитка; 3 – насичений розчин КС1; 4 – отвір для заливки КСl; 5 – гумова пробка; 6 – хлорований срібний дріт; 8 – вивідний контакт електрода порівняння; 9 – стаканчик; 10 – досліджуваний розчин |
Індикаторним називається електрод, потенціал якого залежить від концентрації досліджуваного розчину (активності досліджуваного йона) і визначається за рівнянням Нернста:
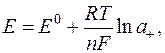
де Е0 – стандартний електродний потенціал – потенціал електрода відносно розчину, де відповідні йони мають активність, що дорівнює одиниці;
R – універсальна газова стала;
T – абсолютна температура;
F – стала Фарадея F ≈ 96491 Кулон/моль-екв.
n – заряд досліджуваного йона;
a+ – активність досліджуваного йона.
У розведеному розчині замість активностей можна взяти концентрації.
Підставляючи значення R, F, взявши температуру T =298 К (25°C) і перейшовши до десяткових логарифмів, отримаємо:

Електродом порівняння називається електрод, потенціал якого має постійне значення.
Основним електродом порівняння є стандартний водневий електрод, для якого прийнято вважати Е 0=0 В.
Працювати з водневим електродом незручно. Простіше працювати з каломельним електродом порівняння, оскільки його потенціал відносно водневого електрода точно відомий.
Як електрод порівняння можна використати хлоросрібний електрод. Хлоросрібний електрод складається із срібного дроту, покритого рівномірним шаром AgCl у розчині, що містить KCl насичений розчин.
Електроди порівняння є слабко поляризованими, потенціал яких не змінюється під час проведення потенціометричного вимірювання, а зміна електрорушійної сили електродної пари буде залежати тільки від потенціалу другого електрода пари – індикаторного електрода.
Індикаторні електроди можуть бути металеві та мембранні. До мембранних йонселективних електродів відносяться скляні, з рідкими, твердими мембранами.

Рис. 6. Каломельний електрод.
1 – шар ртуті; 2 – платиновий дріт для контакту; 3 – скляна трубка;
4 – паста з каломелі; 5 – насичений розчин KCl; 6 – сифон; 7 – бокова трубка;
8 – мідний дріт для включення електрода до приладу.
Скляні електроди виготовляються з тонкого літієво-кальці-алюмосилікатного скла у вигляді кульки. Всередині електрода розташований електрод порівняння, занурений у розчин з фіксованим p H. Загальний потенціал скляного електрода складається з трьох потенціалів: потенціалу внутрішнього електрода порівняння, потенціалу асиметрії та потенціалу, обумовленого різницею концентрацій H+ по обидва боки скляної мембрани. При цьому величини двох перших потенціалів є сталими для певного електрода. Величина третього потенціалу є змінною, оскільки при зануренні скляної мембрани в розчин йони Na+ із скла в процесі йонного обміну заміщуються еквівалентною кількістю йонів H+ з розчину. Таким чином, скляна мембрана являє собою електрод, який є оборотним стосовно йонів H+ і, отже, може бути використаний для вимірювання концентрації йонів H+, тобто p H розчину.
Електрохімічний ланцюг має такий вигляд:

Рис.7. Електрохімічний ланцюг.
φ4 описується законом Нернста.
Електрорушійна сила ланцюга дорівнює різниці потенціалів електрода порівняння та індикаторного електрода:
ЕРС = Eпор–Еінд+Ед,
Де Ед – дифузійний потенціал, що виникає на межі розділу двох рідинних фаз електрохімічного ланцюга.
Для сольового містка використовують солі з близькими значеннями рухливості катіона та аніона. Найчастіше це насичений розчин KCl. У такому разі Ед практично дорівнює нулю.
Потенціометричні методи аналізу поділяються на пряму потенціометрію або йонометрію та потенціометричне титрування.
Пряма потенціометрія (йонометрія) базується на визначенні концентрації досліджуваного йона за величиною ЕРС електрохімічного ланцюга з індикаторним електродом, селективним до цього йона. Для цього вимірюють ЕРС ланцюга із стандартними розчинами та будують графік у координатах: ЕРС –lg с. Потім вимірюють ЕРС ланцюга з досліджуваним розчином і за графіком визначають концентрацію. У стандартні та досліджувані розчини попередньо вводять індиферентний електроліт з високою концентрацією для утворення постійної йонної сили розчину.
У деяких випадках градуюють шкалу не у значеннях ЕРС, а безпосередньо у p H чи p Na, p K та ін.
Потенціометричний метод визначення концентрації йонів у розчині за допомогою йон-селективних електродів ґрунтується на вимірюванні електрохімічного потенціалу, зануреного в досліджуваний розчин зворотного електрода.
Вимірювання потенціометричним методом здійснюється при використанні електродів, які допомагають встановити процес перенесення або розділення зарядів, що виникають на межі розділу фаз.
При зануренні такого електрода в розчин електроліту, який містить однойменний із металом йон, виникає різниця потенціалів між електродом і розчином, яка залежить від активності йона металу.
Якщо електрод вкрити тонким шаром важкорозчинної сполуки (наприклад, Ag/AgCl), яка занурена в розчин з однойменним аніоном, то різниця потенціалів залежатиме від активності відповідного аніона в розчині.
У разі, якщо шар важкорозчинної сполуки містить другий катіон, який утворює з аніоном також важкорозчинну сполуку, але з більшою розчинністю, ніж розчинність сполуки металу електрода (наприклад, Ag/Ag2S/CuS), різниця потенціалів буде залежати від активності другого катіона в розчині. Такі електроди дозволяють селективно визначати будь-який йон за наявності інших йонів у розчині.
Цей вид електродів виготовляється на основі напівпроникності мембран, які характеризуються підвищеною вибірковістю відносно певного типу йонів. Мембрана може бути гомогенною (монокристал, скло) і гетерогенною. У цьому випадку кристалічна речовина міститься в плівці полімеру.
Потенціометричне титрування ґрунтується на визначенні точки еквівалентності за зміною ЕРС потенціометричної комірки у ході титрування.
Точку еквівалентності визначають за інтегральною кривою титрування, яку будують у координатах: ЕРС – VТ (об’єм титранту). У точці еквівалентності спостерігається перегин кривої титрування.
Будують диференційну криву титрування у координатах:  , де Δ Е – зміна ЕРС при зміні об’єму титранту Δ V; точка еквівалентності визначається як максимум кривої титрування.
, де Δ Е – зміна ЕРС при зміні об’єму титранту Δ V; точка еквівалентності визначається як максимум кривої титрування.
Потенціометричне титрування дозволяє визначати точку еквівалентності при титруванні непрозорих і забарвлених розчинів. З електрохімічних методів потенціометричні методи аналізу використовуються найчастіше; вони можуть бути повністю автоматизовані.






