1. Яка молярна концентрація еквівалентна розчину сульфатної кислоти, титр якого становить 0,02446 г/см 3? (ƒ екв (H2SO4)=½).
Відповідь: 0,4988 моль/дм 3.
2. Яка молярна концентрація еквівалентна розчину хлоридної кислоти, якщо Т (КCl/КОН)=0,01353 г/см 3?
Відповідь: 0,2501 моль/дм 3.
3. Яка молярна концентрація еквівалентна розчину натрій гідроксиду, якщо Т (NaOH/SO3)=0,02174 г/см 3?
Відповідь: 0,5431 моль/дм 3.
4. Молярна концентрація еквівалентна розчину сульфатної кислоти становить 0,1008 моль/дм 3 (ƒ екв (H2SO4)=½). Розрахувати титр цього розчину.
Відповідь: 0,004943 г/см 3.
5. Розрахувати Т (КОН/SO3), якщо молярна концентрація еквівалента речовини КОН у цьому розчині становить 0,1021 моль/дм 3.
Відповідь: 0,004087 г/см 3.
6. У розчині об’ємом 500 см 3 міститься 2,6578 г Na2CO3. Розрахувати молярну концентрацію еквівалента і титр цього розчину при взаємодії Na2CO3 з HCl до СО2.
Відповідь: 0,1003 моль/дм 3; 0,005316 г/см 3.
7. У розчині об’ємом 1500 см 3 міститься 28,00 г КОН і 40,20 г NaOH. Яка молярна концентрація еквівалента цього розчину?
Відповідь: 1,0030 моль/дм 3.
8. До розчину хлоридної кислоти об’ємом 550 см 3 (с ( НCl)=0,1925 моль/дм 3) додали розчин хлоридної кислоти об’ємом 50 см 3, титр якого становить 0,02370 г/см 3. Яка молярна концентрація еквівалента і титр отриманого розчину?
НCl)=0,1925 моль/дм 3) додали розчин хлоридної кислоти об’ємом 50 см 3, титр якого становить 0,02370 г/см 3. Яка молярна концентрація еквівалента і титр отриманого розчину?
Відповідь: 0,2306 моль/дм 3; 0,008408 г/см 3.
9. Який об’єм води треба додати до 1 дм 3 розчину хлоридної кислоти (с ( НCl)=0,5300 моль/дм 3), щоб отримати розчин з молярною концентрацією еквівалента речовини НCl 0,5000 моль/дм 3?
НCl)=0,5300 моль/дм 3), щоб отримати розчин з молярною концентрацією еквівалента речовини НCl 0,5000 моль/дм 3?
Відповідь: 60 см 3.
10. Який об’єм хлоридної кислоти (d =1,19 г/см 3) треба взяти для приготування розчину об’ємом 1 дм 3 з молярною концентрацією еквівалента речовини НCl 0,1000 моль/дм 3?
Відповідь: 8 см 3.
11. Який об’єм сульфатної кислоти (d =1,835 г/см 3) треба взяти для приготування розчину об’ємом 2,5 дм 3 з молярною концентрацією еквівалента речовини H2SO4 0,2000 моль/дм 3? (ƒ екв (H2SO4)=½).
Відповідь: 27,9 см 3.
12. Для приготування розчину хлоридної кислоти об’ємом 500 см 3 було взято 20,00 см 3 розчину хлоридної кислоти (d =1,19 г/см 3). Яка молярна концентрація еквівалента отриманого розчину?
Відповідь: 0,5000 моль/дм 3.
13. Розрахувати молярну концентрацію еквівалента розчину хлоридної кислоти і титр цього розчину, якщо на титрування 0,4217 г бури Na2B4O7·10H2O було витрачено 17,50 см 3 розчину кислоти.
Відповідь: 0,1234 моль/дм 3.
14. Розрахувати молярну концентрацію еквівалента розчину H2SO4, якщо до 10 см 3 цього розчину додали надлишок ВаCl2. Маса отриманого осаду після фільтрування, прожарювання і зважування становила 0,2762 г.
Відповідь: 0,1188 моль/дм 3.
15. Оксалатну кислоту Н2С2О4·2Н2О масою 0,600 г розчинили у воді і довели об’єм розчину до 100,0 см 3. На титрування 20,00 см 3 отриманого розчину було використано 18,34 см 3 розчину NaOH. Визначити молярну концентрацію еквівалента розчину натрій гідроксиду і Т (NaOH/H2C2O4).
Відповідь: 0,1039 моль/дм 3; 0,004677 г/см 3.
16. До якого об’єму треба довести розчин, що містить 1,5300 г NaOH, водою, щоб на титрування 20,00 см 3 розчину використати 14,70 см 3 розчину хлоридної, титр якого становить 0,003800 г/см 3?
Відповідь. 500,0 см 3.
17. Яка маса Na2CO3 міститься у розчині, якщо на нейтралізацію до NaHCO3 пішло 21,40 см 3 розчину хлоридної кислоти, титр якого становить 0,002789 г/см 3?
Відповідь: 0,1735 г.
18. На титрування розчину, у якому розчинено 0,1370 г щавлевої кислоти, було використано 22,10 см 3 розчину натрій гідроксиду (с ( NaOH)=0,0984 моль/дм 3). Скільки молекул кристалізаційної води містить кислота?
NaOH)=0,0984 моль/дм 3). Скільки молекул кристалізаційної води містить кислота?
Відповідь: 2.
19. Технічну буру масою 2,0712 г розчинили у мірній колбі і довели об’єм водою до 100,0 см 3. На титрування 20,00 см 3 отриманого розчину пішло 21,80 см 3 розчину хлоридної кислоти (Т (НCl/NaOH)=0,003974 г/см 3). Визначити масову частку Na2B4O7·10H2O у технічній бурі.
Відповідь: 99,71%.
20. На титрування розчину, що містить 3,1580 г технічного КОН, використано 27,45 см 3 розчину НCl (Т (HCl/NaOH)=0,07862 г/см 3). Визначити масову частку КОН у зразку.
Відповідь: 95,87%.
21. На нейтралізацію 0,2000 г суміші хімічно чистих натрій карбонату і калій карбонату було витрачено 11,00 см 3 розчину кислоти (с ( кислоти)=0,3000 моль/дм 3). Розрахувати масові частки Na2CO3 i K2CO3 у суміші.
кислоти)=0,3000 моль/дм 3). Розрахувати масові частки Na2CO3 i K2CO3 у суміші.
Відповідь: 46,16% Na2CO3; 53,84% К2CO3.
22. Технічний натрій гідроксид масою 0,3251 г розчинили у воді в мірній колбі на 100,0 см 3 і довели об’єм водою до риски. На титрування отриманого розчину об’ємом 25,00 см 3 було витрачено 20,00 см 3 розчину хлоридної кислоти (с ( НCl)=0,4455 моль/дм 3). Визначити масову частку NaOH у технічному зразку.
НCl)=0,4455 моль/дм 3). Визначити масову частку NaOH у технічному зразку.
Відповідь: 88,59%.
23. На титрування з фенолфлатеїном наважки 0,4478 г суміші Na2CO3, NaHCO3 i NaCl пішло 18,80 см 3 розчину кислоти з молярною концентрацією еквівалента 0,1998 моль/дм 3. На титрування з метиловим оранжевим на ту ж наважку пішло 40,00 см 3 кислоти. Визначити масові частки компонентів суміші.
Відповідь: 88,91% Na2CO3; 9,00% NaHCO3; 2,09%NaCl.
24. Технічний натрій гідроксид масою 0,4000 г розчинили у мірній колбі на 100,0 см 3 і довели об’єм водою до риски. На титрування 20,00 см 3 отриманого розчину з метиловим оранжевим використали 19,20 см 3 розчину хлоридної кислоти (Т (НCl)=0,003600 г/см 3). Таку ж пробу розчину обробили розчином ВаCl2 з молярною концентрацією еквівалента ВаCl2 2,0000 моль/дм 3 до повного осадження карбонатів і при титруванні з фенолфлатеїном використали 18,80 см 3 розчину хлоридної кислоти. Визначити масову частку карбонатних домішок у препараті.
Відповідь: 2,62%.
25. Визначити тимчасову жорсткість води, якщо на титрування з метиловим оранжевим 200,0 см 3 досліджуваної води використали 10,00 см 3 розчину НCl, титр якого становить 0,001760 г/см 3.
Відповідь: 2,4 ммоль/дм 3.
26. До суміші SrCO3 i Li2CO3 загальною масою 0,4789 г додали 40,00 см 3 розчину хлоридної кислоти (с ( НCl)=0,5100 моль/дм 3). Надлишок кислоти відтитрували розчином натрій гідроксиду. На титрування пішло 20,00 см 3 NaOH (Т (NaOH/HCl)=0,018525 г/см 3). Які масові частки SrCO3 i Li2CO3 у суміші?
НCl)=0,5100 моль/дм 3). Надлишок кислоти відтитрували розчином натрій гідроксиду. На титрування пішло 20,00 см 3 NaOH (Т (NaOH/HCl)=0,018525 г/см 3). Які масові частки SrCO3 i Li2CO3 у суміші?
Відповідь: 40,15% SrCO3; 59,85% Li2CO3.
27. До суміші Na2CO3 i NaHCO3 масою 0,5000 г додали 25,00 см 3 розчину хлоридної кислоти, титр якого становить 0,004000 г/см 3. На титрування надлишку кислоти витрачено 15,00 см 3 розчину натрій гідроксиду, титр якого дорівнює 0,002000 г/см 3. Яка масова частка Na2CO3 у суміші?
Відповідь: 66,52%.
28. Суміш хімічно чистих NaH2PO4 i Na2HPO4 загальною масою 4,8215 г розчинили в 200,0 см 3 розчину хлоридної кислоти (с ( НCl)=0,1982 моль/дм 3). На титрування 20,00 см 3 отриманого розчину з фенолфлатеїном витрачено 21,00 см 3 розчину натрій гідроксиду, титр якого становить 0,002000 г/см 3. Визначити масову частку Na2HPO4 у суміші.
НCl)=0,1982 моль/дм 3). На титрування 20,00 см 3 отриманого розчину з фенолфлатеїном витрачено 21,00 см 3 розчину натрій гідроксиду, титр якого становить 0,002000 г/см 3. Визначити масову частку Na2HPO4 у суміші.
Відповідь: 27,47%.
29. До кристалічного Na3PO4 масою 0,1000 г додали 25,00 см 3 розчину сульфатної кислоти (с (½H2SO4)=0,2 моль/дм 3). На зворотне титрування залишку кислоти з метиловим оранжевим витратили 15,00 см 3 розчину натрій гідроксиду. Яка молярна концентрація еквівалента розчину NaOH?
Відповідь: 0,5850 моль/дм 3.
30. Анілін масою 0,0327 г розчинили у 50,00 см 3 безводної оцтової кислоти і відтитрували розчином НClО4 у безводній оцтовій кислоті (с ( НClО4)=0,1000 моль/дм 3) з кристалічним фіолетовим. Який об’єм титранту пішов на тирування?
НClО4)=0,1000 моль/дм 3) з кристалічним фіолетовим. Який об’єм титранту пішов на тирування?
Відповідь: 35,2 см 3.
31. Яка молярна концентрація еквівалента розчину натрій хлориду, якщо на титрування 20,00 см 3 цього розчину витрачається 18,62 см 3 розчину Hg(NO3)2 (с (½Hg(NO3)2)=0,1000 моль/дм 3)?
Відповідь: 0,0931 моль/дм 3
32. На титрування розчину NaCl, що містить 0,1050 г натрій хлориду, використано 20,00 см 3 розчину Hg2(NO3)2. Яка молярна концентрація еквівалента розчину Hg2(NO3)2?
Відповідь: 0,08983 моль/дм 3.
33. На титрування розчину, отриманого розчиненням 0,2082 г NaBr, використано 22,80 см 3 розчину Hg2(NO3)2. На титрування 20,0 см 3 Hg2(NO3)2 витрачено 19,82 см 3 розчину NH4SCN. Визначити молярну концентрацію еквівалента і титр розчину NH4SCN.
Відповідь: 0,08954 моль/дм 3; 0,006816 г/см 3
34. Розрахувати молярну концентрацію еквівалента і титр розчину трилону Б, якщо на титрування 25,00 см 3 цього розчину використано 24,45 см 3 розчину ZnSO4 (c (ZnSO4)=0,1100 моль/дм 3).
Відповідь: 0,1075 моль/дм 3; 0,02001 г/см 3
35. Яка маса натрій хлориду міститься в 250,0 см 3 розчину, якщо на титрування 25,00 см 3 цього розчину використано 26,45 см 3 розчину AgNO3 (c ( AgNO3)=0,0500 моль/дм 3)?
AgNO3)=0,0500 моль/дм 3)?
Відповідь: 0,7729 г.
36. У мірну колбу на 250,0 см 3 внесли 25,00 см 3 розведеної хлоридної кислоти і довели водою до риски. На титрування 20,00 см 3 отриманого розчину використано 24,37 см 3 розчину AgNO3 (c ( AgNO3)=0,9850 моль/дм 3). Розрахувати масу HCl, що міститься в 1 дм 3 досліджуваної кислоти.
AgNO3)=0,9850 моль/дм 3). Розрахувати масу HCl, що міститься в 1 дм 3 досліджуваної кислоти.
Відповідь: 437,61 г.
37. Який об’єм розчину калій ціаніду, молярна концентрація еквівалента якого становить 0,1056 моль/дм 3, необхідний для титрування 20,00 см 3 розчину аргентум нітрату (Т (AgNO3)=0,01126 г/см 3)?
Відповідь: 12,55 см 3.
38. Визначити масову частку срібла у сплаві, якщо після розчинення 0,2000 г цього сплаву на титрування отриманого розчину використано 39,60 см 3 розчину, що містить 0,4103 KSCN у 100,0 см 3. Вважати, що інші компоненти сплаву з йонами SCN– не утворюють малорозчинні осади.
Відповідь: 90,17%.
39. Технічний KBr масою 0,3838 г розчинили у воді. На титрування отриманого розчину було використано 23,80 см 3 розчину AgNO3, T (AgNO3/Cl–)=0,003546 г/см 3. Визначити масову частку KBr у зразку.
Відповідь: 73,81%.
40. Після відповідної обробки, скло масою 3,0340 г перевели у розчин і об’єм розчину довели водою до 100,0 см 3. На титрування 20,00 см 3 отриманого розчину було використано 7,06 см 3 розчину трилону Б (с =0,0050 моль/дм 3). Визначити масову частку Fe у склі.
Відповідь: 0,32%.
41. На титрування 20,00 см 3 розчину оксалатної кислоти, титр якого становить 0,006900 г/см 3, використано 25,00 см 3 розчину KMnO4. Розрахувати молярну концентрацію еквівалента і титр розчину KMnO4.
Відповідь: 0,08656 моль/дм 3; 0,002768 г/см 3.
42. На титрування 25,00 см 3 розчину FeSO4 в H2SO4 використано 31,25 см 3 розчину K2Cr2O7 (c (1/6K2Cr2O7)=0,1000 моль/дм 3). Який об’єм води слід додати до 20,00 см 3 розчину FeSO4, щоб отримати розчин з молярною концентрацією еквівалента речовини FeSO4 точно 0,0500 моль/дм 3?
Відповідь: 300,0 см 3.
43. Розрахувати масову частку H2C2O4·2H2O у технічному препараті щавлевої кислоти, якщо на титрування розчину, отриманого розчиненням 0,2003 г технічного препарату кислоти, було витрачено 29,30 см 3 розчину KMnO4, 1,00 см 3 якого еквівалентний 0,006023 г Fe.
Відповідь: 99,45%.
44. Яка маса Н2О2 міститься у розчині, якщо на його титрування використано 14,50 см 3 розчину KMnO4, 1,00 см 3 якого еквівалентний 0,08376 г Fe?
Відповідь: 0,03532 г.
45. Який об’єм розчину, що містить 25,00 г/дм 3 K2Cr2O7, еквівалентний 3,4000 г FeSO4·7H2O в кислому середовищі?
Відповідь: 23,98 см 3.
46. Зразок масою 0,1000 г, що містить 99,98% заліза, розчинили в розчині сульфатної кислоти без доступу повітря і отриманий розчин відтитрували розчином KMnO4 (c (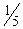 KMnO4)=0,1000 моль/дм 3). Який об’єм розчину KMnO4 пішов на титрування?
KMnO4)=0,1000 моль/дм 3). Який об’єм розчину KMnO4 пішов на титрування?
Відповідь: 17,90 см 3.
47. До розчину, що містить 0,1510 г технічного KClO3, додали 100,0 см 3 розчину Na2C2O4 (c (½Na2C2O4)=0,09852 моль/дм 3), надлишок якого відтитрували розчином KMnO4 (c (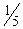 KMnO4)=0,0532 моль/дм 3). На титрування було витрачено 48,60 см 3 розчину калій перманганату. Розрахувати масову частку КClО3 у зразку.
KMnO4)=0,0532 моль/дм 3). На титрування було витрачено 48,60 см 3 розчину калій перманганату. Розрахувати масову частку КClО3 у зразку.
Відповідь: 98,22%.
48. До розчину КСlО3 додали 50,00 см 3 розчину FeSO4 (c ( FeSO4)=0,1048 моль/дм 3), надлишок якого відтитрували розчином KMnO4 (c (
FeSO4)=0,1048 моль/дм 3), надлишок якого відтитрували розчином KMnO4 (c (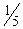 KMnO4)=0,0945 моль/дм 3). На титрування було витрачено 20,00 см 3 розчину калій перманганату. Яка маса КClО3 містилася у розчині?
KMnO4)=0,0945 моль/дм 3). На титрування було витрачено 20,00 см 3 розчину калій перманганату. Яка маса КClО3 містилася у розчині?
Відповідь: 0,06843 г.
49. Визначити масову частку Sn у бронзі, якщо на титрування розчину, отриманого розчиненням 0,9122 г бронзи, використано 15,73 см 3 розчину йоду (с (½І2)=0,03523 моль/дм 3).
Відповідь: 3,61%.
50. Технічний Na2SO3 масою 1,5000 г розчинили у воді і до утвореного розчину додали 100,0 см 3 розчину І2 (с (½І2)=0,1000 моль/дм 3). На титрування надлишку І2 використано 40,00 см 3 розчину, в 200,0 см 3 якого міститься 2,4820 г Na2S2O3. Визначити масову частку Na2SO3 у зразку.
Відповідь: 73,31%.
51. До кислого розчину калій йодиду додали 20,00 см 3 розчину KMnO4 (c (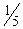 KMnO4)=0,1133 моль/дм 3). Йод, що виділився, відтитрували розчином натрій тіосульфату. На титрування було використано 25,90 см 3 розчину Na2S2O3. Яка молярна концентрація еквівалента розчину натрій тіосульфату?
KMnO4)=0,1133 моль/дм 3). Йод, що виділився, відтитрували розчином натрій тіосульфату. На титрування було використано 25,90 см 3 розчину Na2S2O3. Яка молярна концентрація еквівалента розчину натрій тіосульфату?
Відповідь: 0,08749 моль/дм 3.
52. Руду масою 0,6215 г, що містить Купрум, відповідним чином розчинили і перевели Купрум у розчин у вигляді Сu2+. При додаванні до отриманого розчину надлишку КІ виділився І2, на титрування якого використали 18,23 см 3 розчину Na2S2O3 (T (Na2S2O3/Cu2+) =0,006208 г/см 3). Визначити масову частку Купруму в руді.
Відповідь: 5,67%.
53. До підкисненого розчину Н2О2 додали надлишок КІ і декілька крапель розчину (NH4)2MoO4 як каталізатора. Йод, що виділився, відтитрували розчином натрій тіосульфату (с (Na2S2O3)=0,1010 моль/дм 3). На титрування було витрачено 22,40 см 3 розчину Na2S2O3. Яка маса Н2О2 містилась у розчині?
Відповідь: 0,03845 г.
54. У мірну колбу, об’ємом 250,0 см 3 вмістили 3,3590 г білильного вапна і додали води до риски. На титрування 25,00см3 отриманої суспензії після відповідної обробки було використано 18,29см3 розчину Na2S2O3, титр якого становить 0,015634г/см3. Яка масова частка активного хлору в білильному вапні?
Відповідь: 19,08%.
55. Технічний FeCl3 масою 4,8900 г розчинили у воді у мірній колбі об’ємом 250,0 см 3 і довели водою до риски. До 25,00 см 3 отриманого розчину в кислому середовищі додали надлишок КІ. Йод, що виділився, відтитрували розчином натрій тіосульфату (с (½Na2S2O3)=0,0923 моль/дм 3). На титрування було витрачено 33,0см3 розчину тіосульфату. Яка масова частка FeCl3 у зразку?
Відповідь: 98,28%.
56. З 3,2057 г сплаву осадили свинець у вигляді PbCrO4. Дією на осад кислотою і надлишком КІ виділили І2, на титрування якого витратили 9,15 см 3 розчину Na2S2O3 (c (½Na2S2O3)=0,1028 моль/дм 3). Яка масова частка свинцю у сплаві?
Відповідь: 2,03%.
57. Руду масою 0,2000 г, що містить MnO2, обробили концентрованим розчином хлоридної кислоти. Хлор, що утворився в результаті реакції, відігнали і поглинули розчином KI. Йод, що виділився відтитрували розчином натрій тіосульфату (с (½Na2S2O3)=0,0520 моль/дм 3). На титрування було використано 42,50 см 3 розчину натрій тіосульфату. Яка масова частка MnO2 у руді?
Відповідь: 48,03%.
58. До 25,00 см 3 розчину H2S додали 50,00 см 3 розчину І2 (с (½І2)=0,0196 моль/дм 3). Надлишок І2 відтитрували розчином натрій тіосульфату (с (½Na2S2O3)= =0,0204 моль/дм 3). На титрування було витрачено 11,00 см 3 розчину натрій тіосульфату. Яка маса H2S містилась в 1 дм 3 досліджуваного розчину?
Відповідь: 0,5150 г.
59. Розрахувати масу K2Cr2O7, щоб на титрування І2, який виділився при взаємодії його з надлишком КІ, витратити 35,42 см 3 розчину Na2S2O3 з Т (Na2S2O3/I2)=0,01270 г/см 3.
Відповідь: 0,0159 г.
60. Установлено, що 50,00 см 3 розчину І2 за своєю окисною здатністю еквівалентні 49,47 см 3 розчину К2Cr2O7, 1,00 см 3 якого виділяє з КІ 0,004263 г І2. Які молярні концентрації еквівалентів обох розчинів?
Відповідь: І2 – 0,03328 моль/дм 3; К2Cr2O7 – 0,03858 моль/дм 3.
61. Розрахувати індикаторну похибку титрування розчину NaOH (c (NaOH)=0,1 моль/дм 3) розчином НCl (с (НCl)=0,1 моль/дм 3) з індикатором тимолфталеїном (рТ =10).
Відповідь: 0,2%.
62. З яким індикатором можна відтитрувати розчин CH3COOH, щоб кислотна похибка не перевищувала 0,1%?
Відповідь: фенолфталеїном, тимолфталеїном.
63. Розрахувати індикаторну похибку титрування розчину НCl (с (НCl)=0,2 моль/дм 3) розчином NaOH (с (NaOH)=0,2 моль/дм 3) з індикатором метиловим червоним (pT =5).
Відповідь: 0,01%.






