Речовини реагують між собою в еквівалентних кількостях.
Кількість речовини еквівалента реагенту в точці еквівалентності дорівнює кількості речовини еквівалента досліджуваної речовини.
n ( A) = n (
A) = n ( B)
B)
Еквівалентом називається реальна чи умовна частинка, яка може приєднувати, витісняти чи якимось іншим способом бути еквівалентною одному гідроген-іону в кислотно-основних реакціях чи одному електрону в окисно-відновних реакціях. Умовною частинкою може бути реально існуюча частинка (молекула, йон, електрон та ін.), так і частки таких частинок або їх групи.
Еквівалент можна визначити тільки в конкретній реакції речовини, так як він не є постійною величиною.
Так, в реакції H2SO4+NaOH=NaHSO4+H2O один моль гідроген-іонів сульфатної кислоти взаємодіє з одним молем гідроксид-іонів натрій гідроксиду, тобто мольні співвідношення кислоти і лугу  . Ці співвідношення між молями реагуючих речовин називаються фактором еквівалентності і позначаються символом ƒекв (Х). У даній реакції ƒекв (H2SO4)=
. Ці співвідношення між молями реагуючих речовин називаються фактором еквівалентності і позначаються символом ƒекв (Х). У даній реакції ƒекв (H2SO4)=  =1; ƒекв (NaOH)=
=1; ƒекв (NaOH)=  =1.
=1.
В іншій реакції ½H2SO4+NaOH = ½Na2SO4+H2O з 1 моль натрій гідроксиду взаємодіє ½ моль сульфатної кислоти. Отже ƒекв (H2SO4)=½, а ƒекв (NaOH)=  =1.
=1.
Фактор еквівалентності є безрозмірною величиною, що дорівнює 1 або 1/2, 1/3, 1/4, 1/5 і т.д.
Еквівалент сульфатної кислоти буде:
ƒекв (H2SO4)H2SO4 = H2SO4,
а в другій реакції
ƒекв (H2SO4)H2SO4 = ½H2SO4.
В обох реакціях еквівалент натрій гідроксиду становить:
ƒекв (NaOH)NaOH = NaOH
У окисно-відновній реакції калій перманганату з якимось відновником:
 + 8H+ + 5 ē = Mn2+ + 4H2O;
+ 8H+ + 5 ē = Mn2+ + 4H2O;
ƒекв (KMnO4)= 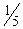 ,
,
а еквівалент KMnO4 буде:
ƒекв (KMnO4)KMnO4 = 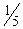 KMnO4;
KMnO4;
у іншій реакції за участі KMnO4:
 + 3 ē + 4H+ = MnO2 + 2H2O
+ 3 ē + 4H+ = MnO2 + 2H2O
фактор еквівалентності KMnO4 ƒекв (KMnO4)=  , а еквівалент KMnO4 становить:
, а еквівалент KMnO4 становить:
ƒекв (KMnO4)KMnO4 =  KMnO4.
KMnO4.
Отже, фактор еквівалентності – це число, що показує, яка частка реальної частинки речовини Х еквівалентна одному гідроген-іону у конкретній кислотно-основній реакції або одному електрону у конкретній реакції окиснення-відновлення.
Еквівалентом називається реальна або умовна частинка речовини Х, яка у конкретній кислотно-основній реакції еквівалентна одному гідроген-іону або в конкретній реакції окиснення-відновлення еквівалентна одному електрону.
Виходячи з цього, молярною масою еквівалента речовини Х називається маса одного моля еквівалента цієї речовини, яка дорівнює добутку фактора еквівалентності на молярну масу речовини Х:
ƒекв (Х)· М (Х); М (½H2SO4) = М (H2SO4)/2; М ( H2SO4)= М (H2SO4).
H2SO4)= М (H2SO4).
Відношення кількості речовини еквівалента у розчині до об’єму розчину називається молярною концентрацією еквівалента:
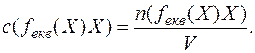
Наприклад,
с (½H2SO4)=0,1 моль/дм 3; с (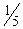 KMnO4)=0,01 моль/дм 3; с (½H2С2O4)=0,05 моль/дм 3.
KMnO4)=0,01 моль/дм 3; с (½H2С2O4)=0,05 моль/дм 3.
Якщо фактор еквівалентності дорівнює одиниці, то, наприклад, замість запису:
с ( NaOH)=0,1000 моль/дм 3,
NaOH)=0,1000 моль/дм 3,
можна говорити не про молярну концентрацію еквівалента розчину, а про молярну концентрацію: с (NaOH)=0,1000 моль/дм 3. Кількість речовини виражається в молях і є відношення речовини в грамах до молярної маси речовини у г/моль:

Аналогічно виражається кількість речовини еквівалента:

Молярна концентрація еквівалента визначається:
 моль/дм 3.
моль/дм 3.
Добуток с ( X)· V (X (p)) є кількість речовини еквівалента речовини Х. З цього випливає, що добуток молярної концентрації еквівалента титранту на об’єм розчину титранту, що пішов на титрування, дорівнює добутку молярної концентрації еквівалента досліджуваної речовини на об’єм розчину досліджуваної речовини, взятого для титрування:
X)· V (X (p)) є кількість речовини еквівалента речовини Х. З цього випливає, що добуток молярної концентрації еквівалента титранту на об’єм розчину титранту, що пішов на титрування, дорівнює добутку молярної концентрації еквівалента досліджуваної речовини на об’єм розчину досліджуваної речовини, взятого для титрування:
с( А)·V(А(p)) = с(
А)·V(А(p)) = с( В)·V(В(p)).
В)·V(В(p)).
Це рівняння застосовується у всіх методах титриметричного аналізу.
Якщо, наприклад, розчин NaOH титрується розчином HCl чи навпаки, то:


n ( NaOH) = n (
NaOH) = n ( HCl);
HCl);

Маса HCl розраховується із співвідношення:

Аналогічно розраховується маса NaOH:

Якщо титрується не весь розчин кислоти чи лугу, а аліквота, то результат аналізу розраховується за рівнянням:


Розчин у титриметричному аналізі інколи характеризують молярною концентрацією еквівалента з поправочним коефіцієнтом. Поправочний коефіцієнт дорівнює відношенню істинної молярної концентрації еквівалента робочого розчину до округленої табличної молярної концентрації еквівалента, для якої можна заздалегідь розрахувати, якій масі досліджуваної речовини відповідає 1 см 3 робочого розчину:

Звідси: c ( X)іст.= c (
X)іст.= c ( X)табл.· K.
X)табл.· K.
У титриметричних методах аналізу широко застосовується вираження концентрації розчину через титр. Титр розчину показує, яка маса розчиненої речовини в грамах міститься в 1 см 3 розчину:

Для масових аналізів корисним є застосування титру робочого розчину (титранту) за речовиною, що визначається. Він показує, якій масі в грамах речовини, що визначається, еквівалентний 1 см 3 розчину титранту певної молярної концентрації еквівалента.
Наприклад, розчин щавлевої кислоти титрується розчином KMnO4 (с (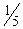 ))=0,1000 моль/дм 3. Тоді
))=0,1000 моль/дм 3. Тоді

Вказувати концентрацію розчину титранту треба обов’язково, тому що від значення цієї концентрації залежить і величина титру.
Застосовуючи такі титри, дуже швидко можна розрахувати масу досліджуваної речовини:
m (досл. реч.) = Т (титрант/досл. реч.)· V (титранту).
Звідси, наприклад у реакції
2KMnO4 +5H2С2O4 + 3H2SO4 = 2MnSO4 +10СO2 + K2SO4 + 8H2O,
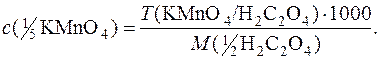
Для даного прикладу титр розчину KMnO4 визначається за формулою:

Виходячи з цієї формули, можна визначити титр розчину, молярну концентрацію еквівалента розчину, молярну масу еквівалента розчинної речовини.
Виходячи з формули:
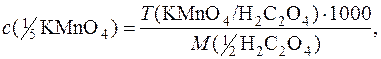
можна визначити молярну концентрацію еквівалента титранту, титр титранту за речовиною, що визначається, молярну масу еквівалента речовини, що визначається.
Коли титрується одним титрантом суміш речовин з відомою загальною масою, розрахунки ведуться наступним чином:
 ;
; 
де m – загальна маса суміші;
w (А) і w (В) – масові чистки компонентів суміші.
n ( А) + n (
А) + n ( В) = n (
В) = n ( титранту);
титранту);
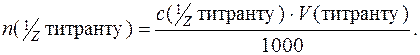
Звідси:

Для визначення кількості речовини еквівалента при розведенні розчину:

де n ( Х) – кількість речовини еквівалента речовини Х;
Х) – кількість речовини еквівалента речовини Х;
с ( Х) – молярна концентрація еквівалента вихідного розчину
Х) – молярна концентрація еквівалента вихідного розчину
речовини Х;
V (Х (р)) – об’єм вихідного розчину;
V (аліквота) – об’єм розведеного розчину, взятий для аналізу;
V (загальний) – загальний об’єм розведеного розчину.
Для розрахунків титру розчину речовини, що визначається, застосовують формулу:

Наприклад, розчином KMnO4 титрують розчин FeSO4:

де V (KMnO4(р)) – об’єм титранту, що пішов на титрування певного об’єму досліджуваного розчину;
V (FeSO4(р)) – об’єм розчину досліджуваної речовини, взятий на титрування.






