Робочими розчинами в йодометрії є розчин йоду і натрій тіосульфату.
Окисником в йодометрії є йод. Він окиснює всі відновники, редокс-потенціал яких менше  = +0,5345 В:
= +0,5345 В:  ,
, 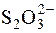 ,
,  , CN–, SCN–, Cr2+ та ін.
, CN–, SCN–, Cr2+ та ін.
Кристалічний йод малорозчинний у воді, тому для приготування стандартного розчину застосовують його розчин в КІ. При розчиненні йоду в калій йодиді утворюються [І3]–-іони, у яких йод зберігає окисні властивості. Нормальний редокс-потенціал системи  = +0,5355 В, тобто окисно-відновні потенціали систем І2/2І– і [І3]–/3І– практично є рівними.
= +0,5355 В, тобто окисно-відновні потенціали систем І2/2І– і [І3]–/3І– практично є рівними.
Схему реакції, що протікає при йодометричних вимірюваннях, можна представити так:
[І3]– + 2 ē = 3І–
Редокс-потенціал цієї системи не залежить від концентрації Н+-іонів, якщо реакції відбуваються в кислих розчинах.
Однак багато речовин, що містять у своєму складі атоми Оксигену, і вступають в реакції з йодид-іонами, у присутності Н+-іонів реагують з утворенням води. Наприклад:
 + 2I– + 14H+ " 2Cr3+ + I2 + 7H2O.
+ 2I– + 14H+ " 2Cr3+ + I2 + 7H2O.
Тому окисно-відновні потенціали таких систем сильно залежать від концентрації у розчині Н+-іонів:

Як відновник в йодометрії є натрій тіосульфат, який реагує з йодом за рівнянням:
I2 + 2 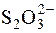 " 2I– +
" 2I– + 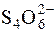 .
.
Розчин тіосульфату використовують для титрування надлишку йоду, що додається у процесі титрування деяких відновників (наприклад  ), або йоду, що утворюється при окисненні йодидів окисниками. Наприклад:
), або йоду, що утворюється при окисненні йодидів окисниками. Наприклад:
Cl2 + 2I– → 2Cl– + I2.
Речовини, що легко окиснюються йодом, тобто такі, редокс-потенціали систем яких менші  , титрують безпосередньо стандартними розчинами йоду в калій йодиді. Такі методи визначення називаються методами прямого йодометричного титрування. За цим методом визначають сульфіди, тіосульфати і інші сильні відновники.
, титрують безпосередньо стандартними розчинами йоду в калій йодиді. Такі методи визначення називаються методами прямого йодометричного титрування. За цим методом визначають сульфіди, тіосульфати і інші сильні відновники.
Речовини, які повільно окиснюються йодом, тобто такі, редокс-потенціал систем яких наближається за своїм значенням до  , визначають методом зворотного йодометричного титрування. Для цього до досліджуваного розчину додають відомий надлишок розчину K[I3], а потім, через деякий час, достатній для окиснення досліджуваної речовини, відтитровують надлишок К[І3] стандартним розчином натрій тіосульфату.
, визначають методом зворотного йодометричного титрування. Для цього до досліджуваного розчину додають відомий надлишок розчину K[I3], а потім, через деякий час, достатній для окиснення досліджуваної речовини, відтитровують надлишок К[І3] стандартним розчином натрій тіосульфату.
До розчину речовин, редокс-потенціал систем яких більше  , додають надлишок калій йодиду чи натрій йодиду, а потім йод, що при цьому виділився в еквівалентній кількості, відтитровують стандартним розчином натрій тіосульфату. Такі методи визначення називаються методами непрямого йодометричного визначення. Наприклад:
, додають надлишок калій йодиду чи натрій йодиду, а потім йод, що при цьому виділився в еквівалентній кількості, відтитровують стандартним розчином натрій тіосульфату. Такі методи визначення називаються методами непрямого йодометричного визначення. Наприклад:
2KMnO4 + 10KI + 8H2SO4 " 2MnSO4 + 5I2 + 6K2SO4 + 8H2O;
5I2 + 10Na2S2O3 " 10NaI + 5Na2S4O6.
За таким методом визначають також хромати, дихромати, йодати, Cl2, Br2, Cu2+, Fe3+ і інші окисники.
Йодометричне визначення кислот
Йодиди з йодатами реагують у присутності кислот:
5I– +  + 6H+ " 3I2 + 3H2O.
+ 6H+ " 3I2 + 3H2O.
Використовуючи цю реакцію, можна визначити кислоти йодометричним методом.
Недоліками йодометричного методу є те, що титрування треба проводити в умовах, щоб запобігти втрати йоду через його леткість, при охолодженні і по можливості швидко. Деякий надлишок КІ зменшує ці помилки титрування. Не дозволяється проводити титрування у хімічному стакані, а тільки у колбі. Недоліком методу є те, що йодид-іони окиснюються киснем повітря:
4І– + О2 + 4Н+ D 2І2 + 2Н2О.
Окисненню І– сприяє зменшення p H розчину і дія сонячного світла. Тому йодометричне титрування слід проводити при невеликій кислотності розчину. При зберіганні стандартних (титрованих) розчинів йоду слід захищати їх від дії прямого сонячного світла і зберігати у посудині з темного скла.
Деякі речовини (Cu2+,  та ін.) індукують окиснення І– киснем повітря.
та ін.) індукують окиснення І– киснем повітря.
Гідроксид-іони викликають реакцію диспропорціювання йоду:
І2 + 2NaOH D NaІO + NaI + H2O.
Тому йодометричне титрування не можна проводити у лужному середовищі.
Недоліком йодометричного титрування є повільна реакція окиснення йодидів окисниками або відновлення І2 відновниками.
Поверхнево-активні речовини і деякі осади, що утворюються в процесі йодометричного титрування, можуть адсорбувати йод. Тому треба енергійно збовтувати розчин у процесі титрування.
У процесі зберігання титри стандартних розчинів йоду і тіосульфату змінюються. Необхідно перед аналізом перевіряти титр тіосульфату за дихроматом, а йоду – за тіосульфатом.
Кристалічний Na2S2O3·5H2O легко втрачає кристалізаційну воду, тому його стандартний розчин за точною наважкою приготувати неможливо. Натрій тіосульфат у розчині розкладається вуглекислотою:
Na2S2O3 + CO2 + H2O " NaHCO3 + NaHSO3 + S.
Стандартний розчин натрій тіосульфату слід захищати від СО2 за допомогою хлоркальцієвої трубки. Перед установкою титру розчин натрій тіосульфату повинен постояти близько 2 днів.
Титр розчину тіосульфату може змінюватися внаслідок розкладання речовини під дією кисню повітря:
2Na2S2O3 + O2 " 2Na2SO4 + 2S.
Титрований розчин йоду не можна приготувати розчиненням йоду у воді, тому що його розчинність складає лише 0,028 г на 100 г води при 20ºС. Але йод добре розчиняється у водному розчині калій йодиду з утворенням К[І3], у якому комплексний йон є сильним окисником. Тому титрований розчин йоду готують розчиненням наважки йоду в концентрованому розчині калій йодиду. Титр отриманого розчину встановлюють за стандартним розчином натрій тіосульфату у присутності індикатора крохмалю. Індикатор додають в кінці титрування щоб у процесі титрування йод не відволікався і на окиснення крохмалю. Якщо ж додати крохмаль на початку титрування, то результати титрування натрій тіосульфатом розчину йоду будуть заниженими.






