Найбільш часто застосовується класифікація, за якою всі аніони поділяються на три аналітичні групи у залежності від розчинності їх солей Барію і Аргентуму.
До першої аналітичної групи відносяться аніони  ,
,  ,
,  ,
,  ,
,  ,
, 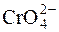 ,
, 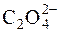 ,
, 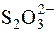 та інші. Груповим реагентом на аніони цієї групи є розчин барій хлориду в нейтральному чи слабколужному розчині. Під дією групового реагенту утворюються практично нерозчинні у воді відповідні солі Барію.
та інші. Груповим реагентом на аніони цієї групи є розчин барій хлориду в нейтральному чи слабколужному розчині. Під дією групового реагенту утворюються практично нерозчинні у воді відповідні солі Барію.
ДР (BaSO4)=1,1·10–10; ДР (BaCrO4)=2,3·10–10;
ДР (BaCO3)=8,0·10–9; ДР (Ba3(PO4)2)=6,0·10–39;
ДР (BaC2O4)=1,7·10–7; ДР (BaSO3)=8,0·10–7.
До другої аналітичної групи аніонів відносяться Cl–, Br–, I–, S2–. Груповим реагентом на аніони цієї групи є розчин AgNO3 у присутності HNO3. При дії групового реагенту утворюються практично нерозчинні у воді і розведеній нітратній кислоті відповідні солі Аргентуму.
ДР (AgCl)=1,78·10–10; ДР (AgI)=8,3·10–17;
ДР (AgBr)=5,3·10–13; ДР (Ag2S)=6,3·10–50.
До третьої аналітичної групи відносяться аніони 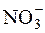 ,
,  , CH3COO–. На аніони цієї групи групового реагенту немає. Всі солі Барію і Аргентуму з цими аніонами розчинні у воді.
, CH3COO–. На аніони цієї групи групового реагенту немає. Всі солі Барію і Аргентуму з цими аніонами розчинні у воді.






