1. Мінімум відкривання натрій-іона за реакцією утворення NaZn(UO2)3(CH3COO)9·9H2O становить 12,5 мкг. Гранична концентрація 1:4000 г/см 3. Розрахувати мінімальний об’єм гранично розведеного розчину, граничне розведення, межу виявлення та показник чутливості реакції.
Відповідь: 0,05 см 3; 4000 см 3/ г; 2,5·10–4 г/см 3; 3,6.
2. Гранична концентрація калій-іона у розчині для реакції з натрій гідрогентартратом NaHC4H4O6 становить 1:1000г/см3. Яку масу KNO3 необхідно взяти для приготування 1 дм 3 цього розчину?
Відповідь: 2,59 г.
3. Мінімум відкривання Ag+-за реакцією
Mn2+ +2Ag+ + 4OH– = MnO2·H2O + 2Ag$ + H2O становить 2 мкг. Гранична концентрація 1:25000 г/см 3. Обчислити показник чутливості реакції і мінімальний об’єм гранично розведеного розчину.
Відповідь: 4,4; 0,05 см 3.
4. Мінімум відкривання йона Ca2+ за реакцією:
Ca2+ + 2  + [Fe(CN)6]4– " Ca(NH4)2[Fe(CN)6]$
+ [Fe(CN)6]4– " Ca(NH4)2[Fe(CN)6]$
становить 25 мкг, межа виявлення 5·10–4 г/см 3. Обчислити масу речовини кальцій-іона в 1 дм 3, граничну концентрацію, граничне розведення, показник чутливості і мінімальний об’єм гранично розведеного розчину.
Відповідь: 0,5 г/дм 3; 1:2000 г/см 3; 2000 см 3/ г; 3,5; 0,05 см 3
5. Мікрокристалоскопічна реакція відкриття йона Ba2+ сульфатною кислотою виходить з розчином об’ємом 0,001 см 3. Гранична концентрація становить 1:20000 г/см 3. Обчислити мінімум відкривання.
Відповідь: 0,05 мкг.
6. Мінімум відкривання йона Al3+ за допомогою алізарину S становить 0,15 мкг. Гранична концентрація 1:333000 г/см 3. Обчислити мінімальний об’єм гранично розведеного розчину і молярну концентрацію еквівалента йона Al3+ у розчині.
Відповідь: 0,05 см 3; 3,34·10–4 моль/дм 3.
7. Мінімум відкривання йона Fe3+ за реакцією:
Fe3+ + 3SCN– " [Fe(SCN)3]
становить 0,25 мкг. Гранична концентрація 1:200000 г/см 3. Обчислити мінімальний об’єм гранично розведеного розчину та межу виявлення Fe3+-іона.
Відповідь: 0,05 см 3; 5·10–6 г/см 3.
8. Мінімум відкривання йона Fe2+ з α,α1-дипіридилом становить 0,03 мкг. Гранична концентрація 1:1666000 г/см 3.Обчислити мінімальний об’єм гранично розведеного розчину та межу виявлення ферум(ΙΙ)-катіона.
Відповідь: 0,05 см 3; 6·10–7 г/см 3.
9. Мінімум відкривання йона Cu2+ за допомогою дитизону (дифенілтіокарбазону) становить 0,03 мкг. Обчислити мінімальний об’єм гранично розведеного розчину і показник чутливості реакції виявлення купрум(ΙΙ)-катіона, якщо граничне розведення розчину дорівнює 1667000 см 3/ г.
Відповідь: 0,05 см 3; 6,22.
10. Мінімум відкривання гідроген пероксиду за реакцією:
PbS + 4H2O2 = PbSO4$ + 4H2O
становить 0,04 мкг. Обчислити граничну концентрацію, якщо мінімальний об’єм гранично розведеного розчину дорівнює 0,05 см 3.
Відповідь: 1:1250000 г/см 3.
11. Визначити масу речовини калій хлориду, яка викристалізується при охолодженні до 20°С розчину масою 626,8 г, насиченого при 100°С, якщо коефіцієнти розчинності калій хлориду становлять 0,567 при 100°С і 0,34 при 20°С.
Відповідь: 90,8 г.
12. Визначити масу води, в якій треба розчинити речовину CuSO4·5H2O масою 91 г, щоб при 30°C утворився насичений розчин CuSO4, якщо коефіцієнт розчинності його за цієї температури дорівнює 0,25.
Відповідь: 200,2 г.
13. Визначити масу речовини Al2(SO4)3·18H2O, яка викристалізується при охолодженні насиченого при 100°С розчину Al2(SO4)3 масою 945 г до 20°С, якщо коефіцієнти розчинності його дорівнюють відповідно 0,890 і 0,364.
Відповідь: 781,7 г.
14. Визначити масову частку речовини КСl у насиченому при 20°С розчині калій хлориду, якщо коефіцієнт розчинності КСl за цієї температури дорівнює 0,34.
Відповідь: 25,37%.
15. Визначити масову частку речовини натрій гідроксиду у розчині, який утворюється при розчиненні Na2O масою 24,8 г у розчині масою 350,4 г з масовою часткою речовини натрій гідроксиду 8,00%.
Відповідь: 16%.
16. Яку масу бури Na2B4O7·10 H2O треба взяти, щоб приготувати водний розчин масою 4 кг з масовою часткою Na2B4O7 5%?
Відповідь: 379,6 г.
17. Яку масу CuSO4·5Н2О необхідно додати до розчину об’ємом 0,5 дм 3 з масовою часткою речовини CuSO4 4,00% і густиною розчину 1,040 г/см 3, щоб одержати розчин з масовою часткою речовини CuSO4 16,00%?
Відповідь: 130 г.
18. Газ гідроген хлорид, одержаний дією надлишку концентрованої сульфатної кислоти на тверду речовину натрій хлорид кількістю речовини 2 моль, розчинили у воді об’ємом 0,3 дм 3. Визначити масову частку речовини гідроген хлориду в отриманому розчині.
Відповідь: 19,57%.
19. До якого об’єму треба розбавити водою розчин сульфатної кислоти об’ємом 1,25 дм 3, щоб зменшити його молярну концентрацію еквівалента речовини H2SO4 від 0,8 до 0,25 моль/дм 3 (fекв (H2SO4)=½)?
Відповідь: 4 дм 3.
20. Розчин натрій гідроксиду об’ємом 2 дм 3 з молярною концентрацією речовини NaOH 0,6 моль/дм 3 змішали з розчином калій гідроксиду об’ємом 3 дм 3 з молярною концентрацією речовини КОН 1 моль/дм 3. Визначити молярну концентрацію кожної речовини в отриманому розчині.
Відповідь: с (NaOH)=0,24 моль/дм 3; с (КОН)=0,60 моль/дм 3.
21. В одному об’ємі води при 20°С розчиняється 702 об’єми амоніаку (н.у.). Визначити масову частку речовини амоніаку у насиченому при 20°С розчині цього газу у воді.
Відповідь: 34,80%.
22. Залізну платівку масою 100 г занурили у розчин купрум(ІІ) сульфату масою 250 г з масовою часткою розчиненої речовини CuSO4 20,00%. Через деякий час платівку вийняли з розчину, промили, висушили і зважили. Її маса стала рівною 102 г. Розрахувати масові частки розчинених речовин у розчині після видалення з нього металічної платівки.
Відповідь: w(FeSO4)=15,32%; w(CuSO4)= 4,00%.
23. При розчиненні сплаву магнію з алюмінієм масою 0,39 г у розчині хлоридної кислоти масою 50 г з масовою часткою речовини НСl 5% виділився газ об’ємом 448 см 3 (н.у.). Обчислити масові частки речовин кожного металу в сплаві і масові частки кожної речовини в отриманому розчині.
Відповідь: 0,12 г; 0,27 г; 30,77%; 69,33%.
24. Визначити молярну концентрацію еквівалента речовини HNO3 у розчині нітратної(V) кислоти з масовою часткою речовини HNO3 44%, якщо густина розчину дорівнює 1,277 г/см 3.
Відповідь: 8,9187 моль/дм 3.
25. Визначити молярну концентрацію еквівалента речовини калій гідроксиду у розчині з масовою часткою речовини КОН 80%, якщо густина розчину дорівнює 1,065 г/см 3.
Відповідь: 15,2143 моль/дм 3.
26. Після встановлення рівноваги реакції між ацетатною кислотою і етанолом з початковими кількостями речовин по 1 моль одержали 0,667 моль етилацетату. Обчислити константу рівноваги реакції.
Відповідь: 4,0.
27. Константа рівноваги реакції А + B D D + Е дорівнює 4. Визначити вихід (%) продукту реакції Д, якщо для проведення реакції взяли 3 дм 3 розчину речовини А (с (А)= 4,0 моль/дм 3) і 7 дм 3 розчину речовини B (с (В) = 2,0 моль/дм 3).
Відповідь: 70,00%.
28. У системі А+2ВDС рівноважні концентрації становлять (в моль/дм 3): [A]=0,06; [B]=1,12; [C]=0,216. Знайти початкові молярні концентрації речовин А і В.
Відповідь: с (А) =0,276 моль/дм 3; с (В)= 0,552 моль/дм 3.
29. За деякої температури швидкість прямої реакції А2+В2 D 2АВ становить 0,16, зворотної - 0,0047. Знайти значення константи рівноваги цієї реакції.
Відповідь: 34.
30. Ступінь дисоціації ацетатної кислоти у водному розчині з молярною концентрацією СН3СООН 0,1 моль/дм 3 становить 1,3%. Знайти масу речовини гідроген-іонів у цьому розчині об’ємом 1 дм 3.
Відповідь: 1,32·10–3 г.
31. Константа дисоціації гідроген ціаніду у водному розчині становить 5·10–10. Визначити молярну концентрацію речовини гідроген-іонів у розчині ціанідної кислоти с (НСN)=0,5 моль/дм 3.
Відповідь: 1,58·10–5.
32. Визначити константу дисоціації ацетатної кислоти у розчині з масовою часткою речовини СН3СООН 3% і ступенем дисоціації 0,6%.
Відповідь: 1,8·10–5.
33. Буферна суміш утворена з 50 см 3 розчину СН3СООН (с (СН3СООН=0,1 моль/дм 3) і 20 см 3 розчину СН3СООNa (c (CH3COONa=0,2 моль/дм 3). Обчислити молярну концентрацію гідроген-іонів у цьому розчині і p H розчину.
Відповідь: 2,17·10–5 моль/дм 3; 4,66.
34. Обчислити активність йонів Mg2+ і Al3+ у розчині, в 1 дм 3 якого міститься 0,1 моль MgSO4 і Al(NO3)3.
Відповідь; а (Mg2+)=0,063 моль/дм 3; а (Аl3+)=0,018 моль/дм 3.
35. Визначити молярну концентрацію речовини амоній гідроксиду (NH3·H2O) у розчині, якщо ступінь дисоціації його дорівнює 1,3%.
Відповідь: 1,041 моль/дм 3.
36. Визначити активність гідроксид-іонів у розчині натрій гідроксиду з молярною концентрацією речовини NaOH 0,06 моль/дм 3.
Відповідь: 0,05 моль/дм 3.
37. Яку кількість речовини ацетатної кислоти необхідно додати до 1 дм 3 розчину натрій ацетату з молярною концентрацією речовини 1 моль/дм 3, щоб p H отриманого розчину став 7,0?
Відповідь: 0,00575 моль.
38. Визначити константу дисоціації НСlО, якщо ступінь дисоціації його у розчині з молярною концентрацією речовини НСlО 0,2 моль/дм 3 становить 0,053%.
Відповідь: 5,62·10–8.
39. Обчислити p H у розчині амоній гідроксиду з молярною концентрацією речовини 0,01 моль/дм 3.
Відповідь: 10,62.
40. Визначити с (Н+), с ( ), c (
), c ( ), у розчині H2SO4 з молярною концентрацією речовини H2SO4 0,01 моль/дм 3.
), у розчині H2SO4 з молярною концентрацією речовини H2SO4 0,01 моль/дм 3.
Відповідь: с (Н+)=1,45·10–2 моль/дм 3; с ( )=5,5·10–3 моль/дм 3;
)=5,5·10–3 моль/дм 3;
c ( )=4,5·10–3 моль/дм 3.
)=4,5·10–3 моль/дм 3.
41. Обчислити p H розчину амоніаку з молярною концентрацією речовини (NH3·H2O) 0,3 моль/дм 3.
Відповідь: 11,36.
42. Обчислити p H розчину, одержаному при змішуванні 150 см 3 розчину форміатної кислоти (с (НСООН)=0,08 моль/дм 3) і 180 см3 розчину натрій форміату (с (НСООNa)=0,15 моль/дм 3).
Відповідь: 4,10.
43. Який об’єм розчину хлоридної кислоти з молярною концентрацією речовини гідроген хлориду 0,1 моль/дм 3 необхідно додати до розчину амоніаку (NH3) об’ємом 50 см 3 з молярною концентрацією речовини 0,25 моль/дм 3, щоб отримати розчин з p H 9?
Відповідь: 79,70см3.
44. Який об’єм розчину натрій гідроксиду з молярною концентрацією речовини NaOH 0,1 моль/дм 3 необхідно додати до 50 см 3 розчину NaH2PO4 з молярною концентрацією речовини NaH2PO4 0,2 моль/дм 3, щоб p H був рівним 7,0?
Відповідь: 38,10 см 3.
45. Яку масу речовини натрій карбонату треба додати до 50 см 3 розчину натрій гідрокарбонату з молярною концентрацією речовини NaHCO3 0,25 моль/дм 3, щоб отримати розчин з p H 10?
Відповідь:0,6341 г.
46. Який об’єм розчину хлоридної кислоти з молярною концентрацією речовини гідроген хлориду 0,1 моль/дм 3 необхідно додати до розчину, що містить натрій карбонат масою 1 г у 250 см 3 води, щоб отримати розчин з p H 10?
Відповідь: 16,30 см 3.
47. Який об’єм розчину калій гідроксиду з молярною концентрацією речовини КОН 0,5 моль/дм 3 треба додати до 50 см 3 розчину К2НРО4 з молярною концентрацією речовини 1 моль/дм 3, щоб отримати розчин з p H 11?
Відповідь: 4,77 см3.
48. Яку масу речовини натрій дигідрогенфосфату (NaH2PO4) необхідно додати до 250 см 3 розчину натрій гідроксиду з молярною концентрацією речовини NaOH 0,15 моль/дм 3, щоб отримати розчин з p H 7,0?
Відповідь: 11,7967 г.
49. На яку величину зміниться p H розчину, що складається з NH3·H2O і NH4Cl з молярними концентраціями речовин 1,1 моль/дм 3, якщо до нього додати розчин гідроген хлориду з молярною концентрацією речовини НСl 0,1 моль/дм 3?
Відповідь: на 0,08.
50. Як зміниться ступінь дисоціації форміатної кислоти, якщо до 400 см 3 її розчину з молярною концентрацією речовин НСООН 0,5 моль/дм 3 додати розчин натрій форміату об’ємом 100 см 3, що містить речовину HCOONa масою 3,4 г?
Відповідь: зменшиться в 10,54 рази.
51. Який p H у розчині амоній гідроксиду (NH3·H2O) з молярною концентрацією речовини амоніаку NH3 0,05 моль/дм 3, до 1 дм 3 якого додали амоній хлорид кількістю речовини 0,1 моль/дм 3 (f ( )=0,76)?
)=0,76)?
Відповідь: 9,0.
52. Обчислити p H розчину, що містить 0,5 моль/дм 3 речовини Н3РО4 і 0,25 моль/дм 3 речовини NaH2PO4.
Відповідь: 1,85.
53. Обчислити рівноважні молярні концентрації H2S і йонів HS– у розчині сульфідної кислоти з молярною концентрацією речовини H2S 0,1 моль/дм 3 при p H=5,0.
Відповідь: [H2S]=1,3·10–3 моль/дм 3; [HS–]=9,9·10–2 моль/дм 3.
54. p H розчину, через який був пропущений гідроген сульфід H2S, дорівнює 8,3. Обчислити рівноважні молярні концентрації йонів HS– і S2– у цьому розчині.
Відповідь: [HS–]=9,52·10–2 моль/дм 3; [S2–]=1,9·10–8 моль/дм 3.
55. Обчислити рівноважні молярні концентрації H2SO3 і йонів  у розчині сульфатної(ІV) кислоти з молярною концентрацією речовини H2SO3 0,1 моль/дм 3 при p H 4,0.
у розчині сульфатної(ІV) кислоти з молярною концентрацією речовини H2SO3 0,1 моль/дм 3 при p H 4,0.
Відповідь: [H2SO3]=7·10–4 моль/дм 3; [  ]=9,93·10–2 моль/дм 3.
]=9,93·10–2 моль/дм 3.
56. Яка молярна концентрація речовини Pb2+ залишається у розчині при осадженні його у вигляді плюмбум сульфату дією еквівалентної кількості сульфатної кислоти?
Відповідь: 1,26·10–4 моль/дм 3.
57. До 50 см 3 розчину аргентум нітрату (с (AgNO3)=1,7·10–4 моль/дм 3) додали 150 см 3 розчину натрій хлориду (с (NaCl)=0,01 моль/дм 3). Обчислити молярні концентрації речовин Ag+ і Cl– у отриманому розчині.
Відповідь: с (Ag+)=2,37·10–8 моль/дм 3; с (Сl–)=7,5·10–3 моль/дм 3).
58. Обчислити молярну концентрацію речовини Ba2+ у розчині, якщо до 100 см 3 розчину барій хлориду (с (ВаСl2)=0,05 моль/дм 3) додали 100 см 3 розчину натрій сульфату (с (Na2SO4)= =0,06 моль/дм 3).
Відповідь: 2,2·10–8 моль/дм 3.
59. Обчислити молярну концентрацію речовини Mg2+-іона у насиченому розчині амоній магній фосфату (MgNH4PO4), в якому молярна концентрація речовини амоній-іона дорівнює 0,5 моль/дм 3, а йона  – 0,001 моль/дм 3.
– 0,001 моль/дм 3.
Відповідь: 5·10–10моль/дм3.
60. Добуток розчинності стронцій сульфату дорівнює 3,2·10–7. Обчислити, в якому об’ємі насиченого розчину міститься Sr2+ кількістю 0,56 моль?
Відповідь: 1 м 3.
61. Добуток розчинності аргентум фосфату дорівнює 1,3·10–20. Обчислити розчинність (моль/дм 3, г/дм 3) аргентум фосфату. В якому об’ємі насиченого розчину міститься Ag+-іон кількістю речовини 0,003 моль?
Відповідь: 4,68·10–6 моль/дм 3; 1,96·10–3 г/дм 3; 214 дм 3.
62. 50 см 3 насиченого розчину аргентум карбонату містять карбонат-аніон кількістю речовини 6,3·10–6 моль. Обчислити добуток розчинності Ag2CO3.
Відповідь: 8·10–12.
63. Обчислити, у скільки разів розчинність (моль/дм 3) Fe(OH)2 у воді більша, ніж розчинність Fe(OH)3 за 25°С.
Відповідь: у 25500 разів.
64. Довести розрахунками, чи утвориться осад AgSO4, якщо до розчину AgNO3 з молярною концентрацією еквівалента речовини AgNO3 0,02 моль/дм 3 додати рівний об’єм розчину сульфатної кислоти з молярною концентрацією еквівалента речовини H2SO4 0,1 моль/дм 3 (fекв. (H2SO4)=½).
Відповідь: ні.
65. Розчинність аргентум йодиду за температури 25°С становить 2,865 мкг/дм 3. Обчислити добуток розчинності аргентум йодиду.
Відповідь: 1,49·10–16.
66. Розчинність кальцій сульфату дорівнює 2 г/дм 3. Насичений розчин кальцій сульфату змішують з рівним об’ємом розчину (NH)4C2O4, який містить 0,0248 г амоній оксалату в 1 дм 3. Обчислити добуток молярних концентрацій Са2+ і 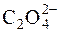 у момент змішування розчинів і підтвердити, чи буде випадати осад кальцій оксалату.
у момент змішування розчинів і підтвердити, чи буде випадати осад кальцій оксалату.
Відповідь: [Ca2+]·[ 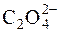 ] = 7,4·10–7; осад утвориться.
] = 7,4·10–7; осад утвориться.
67. Добуток розчинності аргентум тіоціанату дорівнює 1,1·10–12. Обчислити розчинність (моль/дм 3) речовини аргентум тіоціанату у воді і молярну концентрацію речовини Ag+-іона у насиченому водному розчині AgSCN.
Відповідь: 1,05·10–6 моль/дм 3; 1,05·10–6 моль/дм 3 Ag+.
68. За якого співвідношення молярних концентрацій йонів  і
і 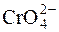 при додаванні розчинів, що містять ці йони, до розчину Pb(NO3)2 обидва аніона одночасно будуть зв’язані в осади?
при додаванні розчинів, що містять ці йони, до розчину Pb(NO3)2 обидва аніона одночасно будуть зв’язані в осади?
Відповідь: 10:1.
69. Визначити молярну концентрацію речовини Cd2+-іона у розчині після осадження їх розчином H2S, якщо молярна концентрація гідроген-іона у розчині дорівнює 0,4 моль/дм 3.
Відповідь: 1,03·10–9 моль/дм 3.
70. Який об’єм розчину амоній хлориду з масовою часткою речовини NH4Cl 15% необхідно додати до 20 см 3 розчину магній хлориду (с (MgCl2)=0,02 моль/дм 3), що містить 1 моль NH3, щоб попередити утворення осаду Mg(OH)2?
Відповідь: 0,73 см 3.
71. Яка повинна бути молярна концентрація речовини гідроксид-іона для маскування осадження цинк карбонату в розчині цинк сульфату (с (ZnSO4)=2,0·10–5 моль/дм 3) при додаванні до нього розчину натрій карбонату (с (Na2CO3)=0,1 моль/дм 3), якщо за цих умов може утворитись комплекс [Zn(OH)4]2–?
Відповідь: 1,71·10–2 моль/дм 3.
72. Визначити ступінь гідролізу натрій гідрогенкарбонату у розчині з молярною концентрацією речовини NaHCO3 0,002 моль/дм 3 за температури 25°С.
Відповідь: 0,34%.
73. Обчислити p H розчину барій ціаніду з молярною концентрацією речовини Ba(CN)2 0,002 моль/дм 3 за 25°С.
Відповідь: 10,3.
74. Обчислити константу і ступінь гідролізу К3РО4 за третьою стадією і p H розчину з молярною концентрацією речовини К3РО4 0,12 моль/дм 3.
Відповідь: 1,4·10–12; 0,000343%; 6,39.
75. Визначити константу і ступінь гідролізу NH4NO3 у розчині з молярною концентрацією солі 0,03 моль/дм 3.
Відповідь: 5,68·10–10; 0,0138%.
76. Обчислити константу і ступінь гідролізу натрій форміату в розчині з молярною концентрацією речовини HCOONa 0,12 моль/дм 3.
Відповідь: 5,6·10–11; 0,0216%.
77. Розрахувати константу гідролізу, ступінь гідролізу і p H у розчині амоній форміату з молярною концентрацією речовини HCOONH4 0,1 моль/дм 3.
Відповідь: 3,16·10–6; 0,177%; 6,5.
78. Обчислити p H водного розчину К2НРО4 з молярною концентрацією речовини 0,1 моль/дм 3.
Відповідь: 9,8.
79. Обчислити p H водного розчину амоній ціаніду з молярною концентрацією NH4CN 0,1 моль/дм 3.
Відповідь: 9,27.
80. У якому об’ємі води необхідно розчинити речовину натрій ацетат масою 0,03 г, щоб отримати розчин з p H 8,0?
Відповідь: 322,7 см 3.
81. Розрахувати  за умови: с (
за умови: с ( )=0,1 моль/дм 3; с (Mn2+)=0,01 моль/дм 3; p H=7,0.
)=0,1 моль/дм 3; с (Mn2+)=0,01 моль/дм 3; p H=7,0.
Відповідь: +0,86 В.
82. Показати, чи може KMnO4 в кислому середовищі окиснити:
1) I– до I2; 2) Fe2+ до Fe3+; 3) H2 до H+; 4) Cl– до Cl2.
83. Користуючись даними довідника про величини стандартних редокс-потенціалів, визначити можливість реакцій між:
1) Ni і HCl; 2) Cu і HCl; 3) Cr і H2SO4; 4) Zn і HCl; 5) Mn і H2SO4.
84. Обчислити молярну концентрацію речовини Ag+-іонів у розчині K[Ag(CN)2] з молярною концентрацією комплексної сполуки 0,1 моль/дм 3.
Відповідь: 7,06·10–8 моль/дм 3.
85. Обчислити молярну концентрацію речовини Fe2+-іонів і частку розпаду комплексного йона у розчині K4[Fe(CN)6] з концентрацією комплексу 0,1 моль/дм 3.
Відповідь: 1,55·10–6 моль/дм 3; 0,155%.
86. Обчислити молярну концентрацію речовини гідроген-іонів, p H і p OH у розчині амоній ацетату з с (CH3COONH4)=0,05 моль/дм 3.
Відповідь: 1·10–7 моль/дм 3; 7; 7.
87. ВСl3 повністю гідролізується з утворенням В(ОН)3 і НСl. Обчислити p H розчину, якщо взято 0,025 моль ВСl3, а об’єм розчину дорівнює 20 дм 3.
Відповідь: 2,52.
88. Водні розчини амоній хлориду, натрій флуориду, натрій нітрату, натрій ціаніду і натрій хлорацетату (CH2ClCOONa) мають однакові молярні концентрації речовин. Розмістити ці розчини за напрямом зростання p H.
89. Чому розчин NaHCO3 має слабколужну реакцію, а розчин NaHSO3 –слабкокислу реакцію?
90. При зливанні водних розчинів Cr(NO3)3 і Na2S утворюється осад і виділяється газ. Скласти рівняння реакцій, які при цьому проходять.
91. Обчислити молярну концентрацію речовини Ag+-іонів у розчині, який містить в 1 дм 3 аргентум нітрат кількістю речовини 0,1 моль і калій ціанід кількістю речовини 2 моль.
Відповідь: 4,35·10–22 моль/дм 3.
92. Яку кількість речовини амоніаку необхідно додати до 1 дм 3 розчину AgNO3 (c (AgNO3) = 0,5 моль/дм 3), щоб молярна концентрація Ag+-іона стала 1·10–5 моль/дм 3, якщо у розчині утворюється комплексний йон [Ag(NH3)2]+?
Відповідь: 1,054 моль.
93. Яку кількість речовини калій йодиду необхідно додати до 1000 см 3 розчину меркурій(ІІ) нітрату, щоб молярна концентрація речовини Hg2+-іона у розчині не перевищувала 1·10–26 моль/дм 3, враховуючи, що в результаті реакції утворюється K2[HgI4]?
Відповідь: 0,4 моль.
94. До розчину, що містить 0,015 моль K3[Cu(CN)4], 0,1 моль K2[Cd(CN)4] і 0,25 моль KCN додали Na2S до молярної концентрації S2– 0,001 моль/дм 3. Чи випадуть осади купрум(І) сульфіду і кадмій сульфіду?
Відповідь: випаде CdS.
95. Чи зруйнується комплекс K3[AlF6], якщо до 10 см 3 його розчину з молярною концентрацією речовини K3[AlF6] 0,05 моль/дм 3 додали такий же об’єм розчину Ca(NO3)2 з молярною концентрацією речовини Ca(NO3)2 0,1 моль/дм 3?
Kн ([AlF6]3–)=1,14·10–31.
Відповідь: так.
96. Обчислити рівноважні молярні концентрації речовин Cd2+, [CdI]+, [CdI2], [CdI3]–, [CdI4]2–, I– у розчині, отриманому при розчиненні речовини CdI2 масою 0,3662 г в 10 см 3 розчину калій йодиду з молярною концентрацією речовини КІ 1,0 моль/дм 3.
Відповідь: (моль/дм 3): [Cd2+]=1,7·10–7; [CdI]+=2,62·10–5; [CdI2]=9,22·10–4; [CdI3]– =8,94·10–3; [CdI4]2– =9,096·10–2; [I–]=0,807.
97. Обчислити молярну концентрацію речовини Fe3+-іонів у розчині FeСl3 (с (FeСl3) = 0,01 моль/дм 3), до 1 дм 3 якого додали калій тіоціанат кількістю речовини 0,1 моль.
Відповідь: 3,6·10–5 моль/дм 3.
98. Обчислити молярну концентрацію речовини Сu2+-іонів у розчині [Cu(NH3)4]SO4 з молярною концентрацією тетраамінкупрум(ІІ) сульфату 0,1 моль/дм 3 у присутності надлишку речовин амоніаку у розчині з молярною концентрацією NH3 0,2 моль/дм 3.
Відповідь: 5,8·10–11 моль/дм 3.
99. Чи випаде осад аргентум хлориду, якщо 0,02 моль AgNO3, 0,02 моль NaCl і 0,5 моль NH3 розчинити в 1 дм 3 води? Відповідь підтвердити обчисленнями.
Відповідь: ні.
100. Знайти частку (%) розпаду комплексного йона у розчині K2[Ni(CN)4] з молярною концентрацією речовини K2[Ni(CN)4] 0,1 моль/дм 3, якщо Kн ([Ni(CN)4]2–=1·10–31.
Відповідь: 2,08·10–5%.






