Диализом называется процесс разделения высокомолекулярных и низкомолекулярных веществ с помощью полупронецаемых мембран. Белковые молекулы, обладая большой молекулярной массой, не способны проникать через полупронецаемые перегородки (искусственные и естественные мембраны). При этом низкомолекулярные частицы (органические и неорганические) легко проходят через поры полупроницаемых мембран.
Диализ широко используется для очистки белков от низкомолекулярных примесей (соли, сахара и других), которые легко проходят через поры полупроницаемых мембран. Прибор, в котором проводят диализ, называется диализатором. Целлофановый или коллодиевый мешочек, опущенный в сосуд с водой, представляет простейший диализатор (рис.1). Белок, помещенный в мешочек, остается в нем, а низкомолекулярные вещества диффундируют через мембрану в воду.
Методом диализа можно разделить альбумины и глобулины. При переходе солей из белкового раствора в окружающую среду глобулины будут выпадать в осадок, т.к. они не растворимы в водной среде, а альбумины будут оставаться в растворе. Простейшим диализатором может служить целлофановый мешочек, опущенный в стакан с водой. Солевой раствор белка помещают в мешочек, при этом молекулы низкомолекулярных веществ (ионы соли) диффундируют через стенку мешочка, а крупные молекулы белка остаются внутри мешочка.
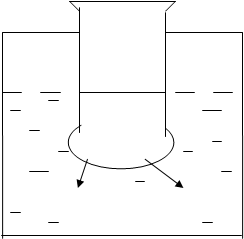 |
Белок +
(NН4)2SО4
2 NН4+ SО42-
Н2О
Рисунок 1- Схема диализатора
Ход работы. 10–15 мл раствора яичного белка, содержащего альбумины, глобулины и сульфат аммония, помещают в целлофановый мешочек и погружают в стакан с дистиллированной водой так, чтобы уровень жидкости в мешочке совпадал с уровнем воды. Для ускорения диализа необходимо менять воду в сосуде. Через 1 час анализируют воду из стакана: в одной пробирке проводят биуретовую реакцию и убеждаются, что белки через мембрану не проходят; в другой пробирке проводят реакцию на ион SO42-, добавлением нескольких капель 10%-ного раствора ВаСI2 для установления проникновения соли через стенку целлофанового мешочка. Через 2–3 часа отмечают появление осадка глобулинов внутри мешочка, который отфильтровывают. В фильтрате остаются белки альбуминовой фракции.
Глобулиновую природу белков осадка доказывают растворением его в растворах солей (10%-ный раствор хлористого аммония, хлористого натрия и др.) При разбавлении раствора водой вновь выпадает осадок.
Альбуминовую природу белков фильтрата подтверждают разбавлением водой с отсутствием осадка или полным насыщением сернокислым аммонием (выпадает осадок).
Материалы и реактивы: раствор яичного белка, содержащего альбумины, глобулины и сульфат аммония (см. приложение Б, п.5); 10%-ный раствор хлористого бария; 10%-ный раствор едкого натра; 1%-ный раствор медного купороса; 10%-ный раствор хлористого аммония; сернокислый аммоний, тонко измельченный.
Оборудование: пробирки обыкновенные; целлофановый или коллодиевый мешочек; химический стакан или сосуд на 1–2 мл; пипетки мерные на 10 мл; пипетки.
Контрольные вопросы
1. Принцип процесса диализа.
2. Устройство простейшего диализатора.
3. Для каких целей применяется диализ?
4. Почему методом диализа можно отделить глобулины (солерастворимые белки) от глобулинов (водорастворимые белки)?
5. Как доказать глобулиновую и альбуминовую природу белков при их разделении?
6. Реакции, используемые для доказательства протекания процесса диализа.






