Многообразие известных координационные соединения можно достаточно полно отразить в различных типах классификации. Зачастую одни и те же соединения могут быть представлены в различных классах в зависимости от признака, взятого за основу.
Если в основу классификации координационных соединений положен заряд координационной сферы, то можно выделить четыре типа комплексов.
1. Молекулярные координационные соединения, внутренняя сфера которых не имеет заряда, например, [Pt(NH3)2Cl2], [Pt(NH3)2(OH)2].
2. Если заряд комплексной частицы положительный, координационные соединения называют катионными, например, [Co(NH3)6]Cl3, [Pt(NH3)4](OH)2.
3. Анионные комплексы имеют отрицательный заряд внутренней сферы, например, K3[Fe(CN)6], K3[Сo(NO2)6].
4. Катионно-анионные координационные соединения состоят из комплексных катиона и аниона, например, [Pt(NH3)3Cl]2[PtCl4].
Если определяющим признаком координационных соединений выбрать число центральных атомов, то их можно разделить на моноядерные, например, [Co(NH3)6]Cl3, Fe(CO)5 и многоядерные комплексы (например, биядерные Fe2(CO)9 и Mn2(CO)10, трехядерные - Os3(CO)12, полиядерные - Co4(CO)12.
Среди многоядерных координационных соединений можно выделить комплексы, в которых центральные атомы соединены посредством лигандов, выполняющих мостиковую функцию. Например:

Многоядерные координационные соединения, в которых осуществляется непосредственная связь металл-металл, получили название кластеров. Первым кластером, строение которого достоверно установлено, был ацетат хрома(II), димерная структура которого выявлена еще в 1953 году.
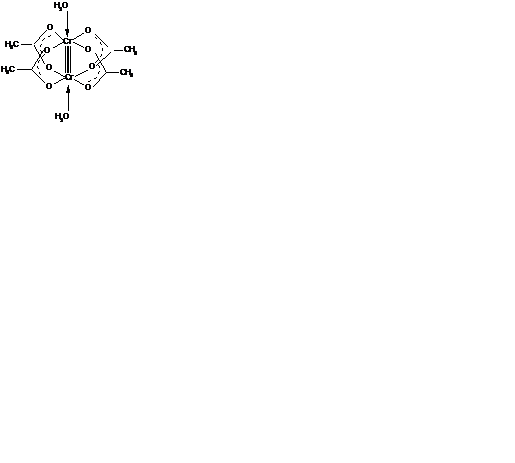
Многоядерные комплексы можно подразделить на гомоядерные и гетероядерные. Последние имеют в качестве центральных атомов ионы различных по природе металлов. Например, получены платиновый и палладиевый комплексы следующего состава:

Следующая классификация координационных соединений основана на характеристике лигандов. Если во внутреннюю координационную сферу входят лиганды одной природы, комплексы называют гомолигандными. Также существуют многочисленные гетеролигандые (разнолигандные) комплексы, например, [Pt(NH3)2Cl2], К[Pt(С2Н4)Cl3]. Гомолигандные координационные соединения в свою очередь можно подразделить на следующие основные типы:
1. Аквакомплексы, в которых в роли лигандов выступают молекулы воды, например, [Cо(H2O)6]Cl2.
2. Аммиакаты или амминокомплексы содержат координированные молекулы аммиака, например, [Co(NH3)6]Cl3.
3. Гидроксокомплексы, в которых центральный атом координирован с гидроксид-анионами, например, K3[Al(OH)6].
4. Ацидокомплексы. В комплексах данного типа роль лигандов выполняют анионы кислотных остатков. Примеры: K3[Fe(CN)6], Na3[AlF6].
5. Гидридокомплексы или комплексные гидриды, содержат в качестве лигандов гидрид-анионы. Примером комплексов данного типа может служить алюмогидрид лития - Li[AlH4].
6. Карбонилы содержат координированные молекулы оксида углерода(II). Примерами карбонилов являются следующие соединения - Ni(CO)4, Fe2(CO)9, Fe3(CO)12.
Полидентатные органические лиганды могут образовывать особые типы координационных соединений: хелаты, комплексонаты и комплексы с макроциклическими лигандами. Хелаты - это координационные соединения, содержащие во внутренней координационной сфере устойчивые циклы, включающие центральный атом. К образованию таких циклов склонны лиганды, содержащие два и более донорных атома. Например, этилендиамин:

К макроциклическим лигандам относят молекулы, содержащие в цикле не менее 9 атомов, 3 и более из которых гетероатомы, являющиеся донорами электронных пар (кислород, сера, азот и т.д.). Примером макроциклических лигандов являются краун-эфиры или циклические полиэфиры, такие как

Первая цифра в названии краун-эфира указывает число атомов или связей в цикле, а вторая - число атомов кислорода. Молекулы краун-эфиров имеют внутренние полости, близкие по размеру к катионам щелочных металлов, с которыми они образуют устойчивые координационные соединения. Варьируя размеры внутренней полости эфира, можно осуществлять процесс комплексообразования селективно.
Краун-эфиры и криптанды интересны тем, что могут рассматриваться в качестве относительно простых модельных систем при исследовании механизма биологического действия ионофоров – переносчиков катионов натрия и калия через клеточные мембраны.
В качестве органических лигандов могут выступать молекулы, не имеющие донорных атомов, а только p-связи. Если в образование координационной связи вовлекаются p-электроны органических лигандов, то такие соединения называются p-комплексами. Существует формальная классификация координационных соединений по числу атомов углерода, образующих p-систему.
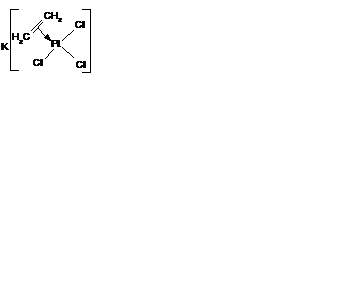
Примером комплекса, в котором органический лиганд предоставляет для образования координационной связи двухэлектронную p-систему, образованную двумя атомами углерода, может служить соль Цейзе:
Примером лигандов, которые координируются центральным атомом за счет четырех электронов, могут служить сопряженные диеновые углеводороды, в том числе и циклопентадиенон:

Исключительно интересными являются p-комплексы с пятиатомными углеводородными радикалами в качестве лиганда. К их числу относится циклопентадиенил - С5Н5, его комплекс с железом(II) называют ферроценом. В ферроцене реализуются координационные связи между катионом железа и шестиэлектронными ароматическими системами двух циклопентадиенильных анионов, расположенных антипараллельно. Циклопентадиенил дает на образование ароматической системы пять электронов, шестой электрон обеспечивает отрицательный заряд аниона. Строение молекулы ферроцена можно представить следующим образом:







