Теория А. Вернера. Теория, адекватно отражающая строение координационных соединений, была создана швейцарским химиком Альфредом Вернером. Её основные положения были изложены в статье "О строении неорганических соединений", опубликованной в 1893 году.
Основные положения теории А. Вернера:
1. Атомы большинства химических элементов имеют главную и побочную валентность. Главная валентность соответствует обычной валентности элемента и проявляется при взаимодействии атомов и радикалов. Побочная валентность обусловлена сочетанием отдельных, способных к самостоятельному существованию молекул или ионов.
2. Атомы каждого элемента стремятся насытить как главную, так и побочную валентности.
3. Химическое сродство, проявляющееся в виде главной и побочной валентности, действует равномерно по всем направлениям в пространстве, в результате чего каждый атом стремится окружить себя другими атомами или атомными группами. Это явление А. Вернер назвал координацией.
Из современных положений координационной химии ушли понятия главной и побочной валентности, которые в значительной степени были уступкой представлениям того времени. Равноценность связей, образованных за счет главной и побочной валентностей, была доказана значительно позже.
Одна из заслуг А. Вернера заключалась в том, что он указал на необходимость при изучении координационных соединений учитывать не только степень окисления металла, но его координационное число. При формулировании координационной теории А. Вернер основывался на экспериментальных фактах. Было получено четыре аммиачных комплекса хлорида кобальта(III):
СoCl3·6NH3 - лутео-хлорид (желтый);
СoCl3·5NH3 - пурпурео-хлорид (темно-красный);
СoCl3·4NH3 - празео-хлорид (зеленый);
СoCl3·4NH3 - виолео-хлорид (фиолетовый).
Вернер установил, что в реакциях этих комплексов с катионами серебра участвует разное число хлорид-ионов.
Особой заслугой А. Вернера является определение объемного строения координационных соединений. Исходя из числа и свойств изомеров комплексов он задолго до экспериментального определения правильно объяснил геометрическую форму координационных соединений. Вернер предположил, что комплексные соединения с координационным числом 6 имеют конфигурацию октаэдра, в центре которого находится ион металла, а лиганды расположены в его вершинах.

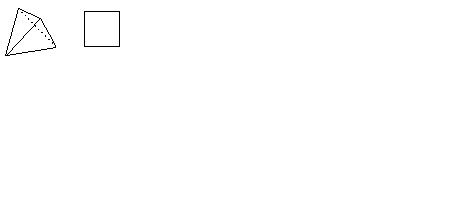
Рис. 2. Геометрия координационных полиэдров комплексов с КЧ центрального атома 6 и 4.
Комплексы с координационным числом 4 имеют тетраэдрическое или плоскоквадратное строение. Изучение изомерии и оптической активности координационных соединений позволило подтвердить гипотезу Вернера о геометрическом строении комплексов.
Современная координационная теория. Современная координационная теория может быть сведена к ряду основных положений:
1. Основой координационных соединений является центральный атом (ион), вокруг которого группируются анионы или нейтральные молекулы.
2. Ионы или молекулы, непосредственно связанные с центральным атомом, называются лигандами. Совокупность лигандов и центрального атома составляет внутреннюю (координационную) сферу.
3. Многогранник, образованный мысленным соединением атомов лигандов, непосредственно связанных с центральным атомом, называется координационным полиэдром.
4. Совокупность ионов и молекул, не связанных с центральным атомом, образует внешнюю сферу. Связь между внутренней и внешней сферами осуществляется за счет сил невалентного взаимодействия (водородные связи, электростатическое притяжение, силы межмолекулярного взаимодействия).
Важнейшей характеристикой центрального атома, наряду с его зарядом (степенью окисления), является координационное число. Координационное число центрального атома определяется числом s-связей, которые он образует с лигандами и равно числу мест во внутренней (координационной) сфере.
Лиганд в координационном соединении характеризуется дентатностью (от латин. dentatus - имеющий зубы, зубчатый) – числом мест координационной сферы, которые он занимает. Дентатность определяется числом s-связей, которыми лиганд связан с центральным атомом. Лиганды, образующие с центральным атомом одну s-связь, называются монодентатными, две s-связи - бидентатными, и т.д. Монодентатными лигандами могут служить молекулы, содержащие один электродонорный атом, и одноатомные лиганды. Например: F-, Cl-, Br -, OH-, R-OH, R-SH, R-NH2, R-PH2. Данные ионы и молекулы могут входить в состав нескольких сопряженных координационных полиэдров, выполняя мостиковую функцию. Например:


Лиганды, содержащие несколько донорных атомов, могут занимать несколько мест во внутренней сфере комплекса и являются полидентатными. Примерами бидентатных лигандов могут служить этилендиамин или карбонат-анион.

Бидентатные лиганды могут связывать два центральных атома, выполняя бидентатно-мостиковую функцию, как, например, ацетат-анион в димерном моногидрате ацетата меди(II) - Cu2(CH3COO)4·2H2O:
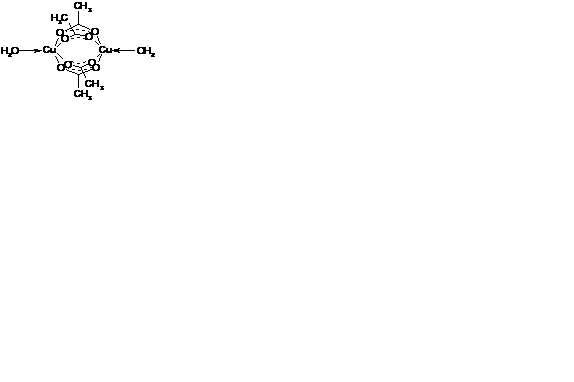
Потенциально бидентатные лиганды часто выполняют монодентатные функции, например:
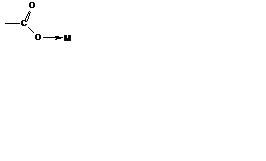
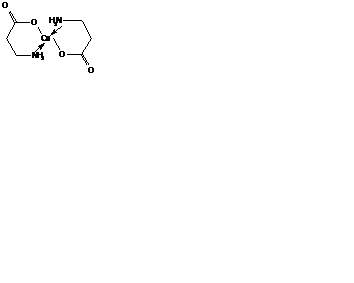
Донорные центры полидентатных органических лигандов могут быть разной природы. Например, b-аланин (H2N-CH2-СН2-COOH) обычно координируется центральным атомом через атом азота аминогруппы и атом кислорода депротонированной карбоксильной группы.
Известны органические лиганды, проявляющие дентатность, равную трем, четырем и выше. Например: 1,2,3-триаминопропан -

способен проявлять дентатность, равную 3.
Для триаминоэтиламина

максимальная дентатность равна 4.
Анионы этилендиаминтетрауксусной кислоты способны связывать центральный атом двумя атомами азота и четырьмя карбоксилатными атомами кислорода, проявляя дентатность 6.







