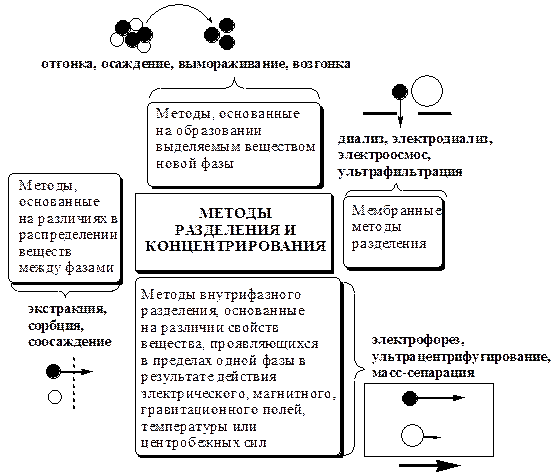Образование малорастворимых соединений приводит к уменьшению концентрации окисленной или восстановленной формы и, следовательно, к изменению величины электродного потенциала.
Пример 7.4. Известно, что 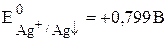 , рассчитайте
, рассчитайте 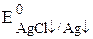
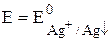
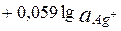
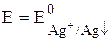
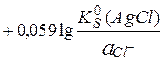
Е = 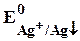
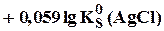
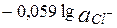
Сумма двух констант в данном выражении, выделенная полужирным шрифтом, представляет собой 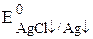
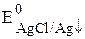 = 0,799 + 0,059lg(1,8×10-10) = 0,23 В
= 0,799 + 0,059lg(1,8×10-10) = 0,23 В
Комплексообразование
Окисленная или восстановленная форма либо они обе вместе могут связываться в комплексные соединения с ионами, присутствующими в растворе. Это приводит к изменению величины электродного потенциала.
Пример 7.5. Известно, что 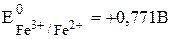 . Рассчитайте величину
. Рассчитайте величину 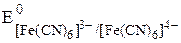
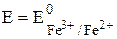
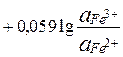
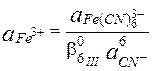
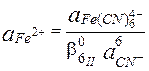
E = 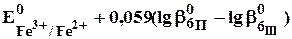 + 0,059
+ 0,059 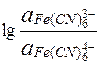
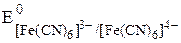 = 0,771 + 0,059×(36,9 - 43,9) = 0,36 В
= 0,771 + 0,059×(36,9 - 43,9) = 0,36 В
Ион Fe3+ образует более устойчивый цианидный комплекс, чем Fe2+, поэтому величина электродного потенциала пары Fe(CN)63-/Fe(CN)64- меньше, чем у пары Fe3+/Fe2+.
7.4. Расчёт различных констант с использованием электродного потенциала
По величине электродных потенциалов можно рассчитать KS малорастворимого электролита, константу образования комплексного соединения, Ka слабой кислоты и т.д.
Пример 7.6. Рассчитать величину 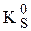 a-модификации CoS, если известно, что
a-модификации CoS, если известно, что 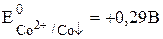 ,
, 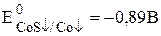
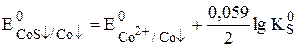
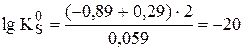
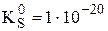
ГЛАВА 8
Отбор пробы
Пробой называется отобранная для анализа часть объекта исследования ( анализируемого образца ).
Небольшая часть анализируемого объекта, средний состав и свойства которой считаются идентичными среднему составу и свойствам анализируемого объекта, называется средней (представительной) пробой.
Различают генеральную, лабораторную и анализируемую пробу.

Величина анализируемой пробы зависит от содержания в ней определяемого компонента и диапазона определяемых содержаний используемой методики анализа. Например, если массовая доля определяемого лекарственного вещества в мази составляет примерно 10%, а нижняя граница определяемой массы данного вещества с помощью используемой методики - 5 мг, то масса пробы мази не должна быть меньше 50 мг. Если же мы хотим определить данное лекарственное вещество в крови больного, где его концентрация ожидается равной 1 мкг/мл, и объём пробы образца составляет всего лишь 5 мл, то нижняя граница определяемой массы с помощью выбранной методики не должна быть больше, чем 5 мкг.
Отбор пробы газов
Генеральная проба газообразных веществ, как правило, бывает небольшой, так как однородность газов велика. Для отбора пробы газообразного вещества используют вакуумные мерные колбы или бюретки с соответствующей запорной жидкостью, а также специальные контейнеры, представляющие собой сосуды из нержавеющей стали, стекла или полимерной плёнки.
Если при отборе пробы газов необходимо проводить и концентрирование определяемых веществ, то определённый объём пробы (от 1 л до 1м3) прокачивают с помощью аспиратора через патрон с сорбентом или поглощающим раствором (так называемую «ловушку»). В последующем вещества из «ловушки» извлекают экстракцией или термодесорбцией.
При отборе пробы газов в замкнутом пространстве (например, в цеху, лаборатории) пробу отбирают в разных точках, а затем смешивают либо анализируют каждую из них отдельно.
Отбор пробы жидкостей
Отбор пробы гомогенной жидкости (например, глазные капли или раствор для инъекций) проводят обычно по объёму, используя для этой цели пипетки или бюретки. Предварительно жидкость тщательно перемешивают. Если анализируемую жидкость сложно или невозможно перемешать (например, содержимое железнодорожной цистерны), то отбор пробы проводят на разной глубине ёмкости (сверху, на середине, снизу) с помощью специальных цилиндрических сосудов (батометров) с закрывающимися сверху и снизу крышками.
Гетерогенные жидкости перед взятием пробы тщательно гомогенизируют путём перемешивания либо вибрации. Пробы таких жидкостей часто отбирают не только по объёму, но и по массе.
Если анализируют жидкость из потока, то для получения достоверной информации пробы отбирают из различных мест по течению водотоков, с различной глубины и через определённые промежутки времени. Правила отбора таких проб регламентируются соответствующими ГОСТами.
Отбор проб твёрдых веществ
Величина генеральной пробы твёрдого вещества зависит от неоднородности образца и размера частиц.
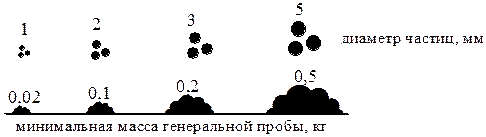
Существует ряд формул, которые можно использовать для примерной оценки массы генеральной пробы твёрдого вещества, например, формула Ричердса-Чеччота
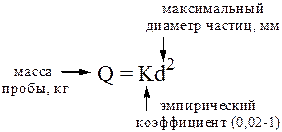
Для практического определения массы генеральной пробы твёрдого вещества можно использовать подход, основанный на определении с помощью однофакторного дисперсионного анализа погрешности пробоотбора. Масса пробы должна быть такой, чтобы погрешность, обусловленная отбором пробы, не превышала 4/5 общей погрешности результата анализа.
Твёрдое вещество может представлять собой единое целое (например, слиток металла) либо быть сыпучим продуктом. Целый твёрдый объект перед отбором из него пробы измельчают (растирают, дробят, распиливают и т.д.). Объекты, представляющие собой сыпучие вещества, перемешивают и затем берут пробу из разных частей ёмкости в верхнем, среднем и нижнем слое в каждой упаковочной единице. Для отбора пробы используют пробоотборники, изготовленные из материалов, не реагирующих с определяемым веществом.
Получение лабораторной пробы
Отобранную генеральную пробу подвергают усреднению, которое подразумевает гомогенизацию и сокращение. Известно множество способов сокращения массы пробы, например, квартование.

Потери определяемого вещества и загрязнения пробы в процессе её отбора и хранения
В процессе отбора проб и их последующего хранения возможно изменение состава и свойств пробы, которое может быть обусловлено:
· потерями компонентов в виде пыли;
· потерями летучих веществ;
· взаимодействием компонентов пробы с кислородом воздуха, материалом посуды;
· адсорбцией компонентов пробы на поверхности посуды.
Пробы можно хранить лишь определённое время, которое зависит от природы анализируемого объекта. Вещества неорганической природы устойчивы длительное время и, как правило, не требуют консервации. Хотя, например, к пробам воды при определении тяжёлых металлов для предупреждения протолитического осаждения определяемых веществ и их адсорбции на стенках посуды в качестве консерванта добавляют кислоты. Пробы, содержащие органические вещества, часто требуют сильного охлаждения, например, пробы биологических жидкостей и тканей замораживают с помощью жидкого азота.
Правильное выполнение процедуры пробоотбора настолько важно, что методика отбора пробы разрабатывается для конкретных объектов и конкретных методов анализа и регламентируется соответствующей нормативной документацией (в фармацевтическом анализе – Государственной фармакопеей и отдельными фармакопейными статьями). При разработке конкретных методик отбора пробы учитывается мнение не только специалистов, которые проводят анализ, но и специалистов, которые его интерпретируют (например, гидрогеологов в случае анализа природных вод или токсикологов в случае анализа тканей и биологических жидкостей и т.д.).
Разложение пробы
Разложением пробы называют процесс переведения определяемых компонентов пробы в физическую и химическую форму, которая наиболее приемлема для выбранного метода определения.
Способы разложения пробы зависят от:
· химического состава образца,
· природы определяемого вещества,
· цели выполнения анализа,
· используемого метода определения.
Способы разложения проб традиционно разделяют на «мокрые» и «сухие». В первом случае на пробу действуют жидким реагентом, (например, водой, органическим растворителем, водным раствором кислоты, щелочи и т.д.). Продуктом, получаемым в результате разложения, является раствор. Во втором случае в результате разложения пробы получают твёрдое вещество (порошок, сплав).
Растворение без протекания химических реакций
Одним из лучших растворителей является вода. В ней хорошо растворяются многие неорганические соединения (соли щелочных металлов и катиона аммония, нитраты, большинство хлоридов и др.) и некоторые органические вещества (низшие многоатомные спирты, аминокислоты, соли образованные анионами органических кислот и катионами щелочных металлов, гидрогалогениды аминов и др.). Для растворения органических веществ используют некоторые органические растворители, например, спирты, хлороформ, диметилформамид, диметилсульфоксид, ацетон и т.д. Иногда в качестве растворителя используют смеси органических веществ с водой (например, водные растворы этанола).
Растворение с участием химических реакций без изменения степеней окисления элементов
Чаще всего для такого растворения используют растворы кислот, анионы которых не обладают окислительными свойствами. При этом в пробу не вносятся посторонние катионы металлов. Наиболее популярным представителем таких кислот является хлороводородная кислота. Она используется в неорганическом анализе для растворения карбонатов, фосфатов, оксидов, гидроксидов, а в органическом анализе – для растворения аминов (в т.ч. алкалоидов), металоорганических соединений и др. Избыток HCl может быть легко удален путём выпаривания пробы досуха. Образовавшийся сухой остаток растворяют в воде. Реже в качестве растворителя используется разбавленная серная кислота (для неокислительного растворения оксидов, гидроксидов, карбонатов).
Кроме растворения в кислотах в отдельных случаях, например, для растворения кислотных оксидов (MoO3, V2O5) или органических веществ кислотного характера, применяется растворение в растворе NaOH. Реже в качестве щелочного растворителя используют растворы Na2CO3 (например, для CaSO4, PbSO4) и NH3 (для AgCl).
Растворение, сопровождающееся протеканием окислительно-восстановительных реакций
Окисление образца азотной кислотой или смесью HNO3 и HCl используется в неорганическом анализе для растворения некоторых металлов (Fe, Mg, Zn и др.) и многих сульфидов. Например
3CuS + 8HNO3 ® 3Cu(NO3)2 + 3S¯ + 2NO + 4H2O
3HgS + 2HNO3 + 12HCl ®3H2[HgCl4] + 3S¯ + 2NO+ 4H2O
Растворение, сопровождающееся протеканием окислительно-восстановительных реакций, широко используется при определении ионов металлов в органических матрицах. Ионы металлов связываются с органическими веществами (аминокислотами, белками и др.) настолько прочно, что извлечь их из матрицы можно, только разрушив органические вещества.
Минерализация – это разрушение органических веществ и материалов на их основе с целью выделения неорганических компонентов (например, ионов металлов) в виде устойчивых и хорошо растворимых соединений, которые затем можно определять соответствующим методом.
Способы минерализации, как и способы разложения пробы вообще, разделяют на «мокрые» и «сухие». «Мокрую» минерализацию чаще всего проводят с помощью кислот-окислителей (HNO3, H2SO4) и их смесей друг с другом и с другими веществами (HNO3 + H2SO4; HNO3 + H2SO4 + HClO4, H2SO4 + H2O2 и др.). Реже окислительную минерализацию проводят в щелочной среде либо в качестве реагентов для минерализации применяют восстановители.
Термическое разложение
Термическое разложение пробы проводят путём её нагревания до высокой температуры (иначе говоря, путём сжигания пробы) на воздухе или в атмосфере кислорода. Органические вещества начинают разрушаться до CO, CO2, H2O и т.д. уже при температуре 300-700 °С, неорганические разрушаются, как правило, при более высоких температурах (1000-1500 °С). Термическое разложение пробы чаще всего проводят путём прокаливания её на воздухе в открытых чашках и тиглях при температуре 500-600 °С или сжиганием в колбе, заполненной кислородом.
Прокаливание на воздухе в открытых сосудах используется для определения зольности органических веществ, при определении тяжёлых металлов в биологических объектах (один из способов «сухой» минерализации). К такому способу разложения пробы прибегают тогда, когда объектом для последующего анализа должно быть твёрдое вещество, а не раствор (например, если анализ будет проводиться атомно-эмиссионным или рентгенофлуоресцентным методами). Данный способ разложения пробы не следует использовать в тех случаях, когда определяемое вещество является летучим.
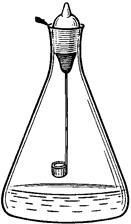 Рис. 8.1. Прибор для сжигания в
кислороде (по ГФ XI)
Рис. 8.1. Прибор для сжигания в
кислороде (по ГФ XI)
|
Сжигание в колбе с кислородом (рис. 8.1) применяют при проведении элементного анализа органических веществ (определении галогенов, серы, фосфора). Органическое вещество сжигают в атмосфере кислорода, а продукты сгорания растворяют в поглощающей жидкости, в роли которой может выступать вода, водные растворы H2O2, NaOH, H2SO4. Элементы, находящиеся в растворе в виде ионов (F-, Cl-, Br-, I-, SO42-, H2PO4- и т.п.), определяют титриметрическим или фотометрическим методом.
Сплавление
Сплавление чаще используется при определении неорганических веществ, чем органических. Измельчённую пробу смешивают с 5-10 кратным избытком реагента и нагревают при определённой температуре, как правило, от 300 до 1000 °С в течение некоторого времени, выбранного опытным путём. Затем получившийся плавень охлаждают и растворяют в воде или кислоте.
В качестве реагентов при сплавлении, происходящем без протекания окислительно-восстановительных реакций, используют карбонаты и гидроксиды щелочных металлов, гидросульфат и пиросульфат калия, смесь Na2CO3 и S. Такой вид сплавления применяют для труднорастворимых оксидов, находящихся в модификациях, которые устойчивы к действию растворов реагентов. Например
SiO2 + Na2CO3 ® Na2SiO3 + CO2
2SnO2 + 2Na2CO3 + 9S ® 2Na2SnS3 + 2CO2 + 3SO2
Al2O3 + KHSO4 ® Al2(SO4)3 + 3K2SO4 + 3H2O
Сплавление, сопровождающееся протеканием окислительно-восстановительных реакций, является одним из видов «сухой» минерализации. В качестве реагента применяется смесь Na2CO3 и NaNO3 или KNO3. Такой способ минерализации используют, например, в химико-токсикологическом анализе при определении так называемых «металлических ядов», а также при проведении элементного анализа фосфор-, мыщьяк- и галогенсодержащих органических веществ.
Нежелательные процессы, происходящие при разложении пробы
В некоторых случаях при разложении пробы часть определяемого вещества может теряться, либо в пробу могут попадать посторонние вещества, мешающие дальнейшему определению целевого компонента. Причинами таких нежелательных явлений могут быть:
· материал, из которого изготовлена химическая посуда;
· недостаточная чистота используемых реактивов;
· сорбция веществ на стенках посуды;
· разбрызгивание, распыление пробы;
· потери легколетучих веществ и т.д.
Для того чтобы уменьшить загрязнение пробы в процессе пробоподготовки, используют посуду, изготовленную из стекла специальных сортов с высоким содержанием SiO2. Стеклянная посуда должна быть хорошо очищена хромовой смесью или смесью концентрированной HCl и H2O2. Чистая посуда меньше сорбирует различные вещества на своих стенках. Стеклянную посуду не следует использовать при работе со щелочными растворами, а также при высокой температуре. Для проведения операций сплавления и сжигания применяют фарфоровую посуду (тигли, выпарительные чашки). Химическая стойкость фарфора выше, чем у лабораторного стекла, его можно использовать при температурах порядка 1100-1300 °С.
В настоящее время всё большее применение находит посуда из кварца, которая устойчива к действию химических реагентов и нагреванию до 1100 °С. Недостаток данного материала – большая хрупкость. Часто используются тигли, изготовленные из металлов (платины, никеля, железа), а также графита, стеклоуглерода. Перспективным материалом для работы при невысоких температурах являются полиэтилен (до 60 °С) и тефлон (до 250 °С).
Для уменьшения сорбции катионов на поверхности посуды пробоподготовку лучше проводить в кислой среде. Органические вещества хорошо сорбируются на пластмассах, что необходимо учитывать при хранении растворённых проб.
Реактивы, используемые для разложения проб, должны, как правило, иметь квалификацию «х.ч.» или «ос.ч.». Для того чтобы учесть влияние реактивов, проводят контрольный опыт, в ходе которого в аналогичных условиях разлагают сходную по составу с анализируемым образцом пробу, не содержащую определяемого компонента.
Для уменьшения потерь от разбрызгивания и улетучивания определяемых веществ нагревание ведут с использованием обратного холодильника. Более перспективным является использование для разложения проб специальных герметично закрывающихся сосудов-автоклавов. Использование таких устройств предотвращает потери от улетучивания и разбрызгивания компонентов пробы. Кроме того, в герметично закрытом автоклаве взаимодействие компонентов пробы с реагентами происходит под давлением (10-20 атм), поэтому скорость разложения пробы при минерализации существенно увеличивается.
В качестве приборов для разложения пробы при высоких температурах в последнее время всё шире используются специальные микроволновые печи. Использование микроволнового нагревания вместо традиционного термического позволяет ускорить процесс разложения пробы в 10-20 раз.
ГЛАВА 9
9.1. Общая характеристика и классификация
Всякий раз, когда химик сталкивается с необходимостью анализа сложного объекта, в котором наряду с интересующим его соединением содержится много других веществ, и, кроме того, концентрация этого соединения очень мала, перед ним обязательно встают следующие проблемы. Во-первых, как добиться того, чтобы посторонние вещества не мешали определению? Во-вторых, можно ли повысить концентрацию вещества в исследуемом объекте? Для решения подобных проблем в аналитической химии используют разнообразные методы разделения и концентрирования.
Разделение - любой процесс или операция, в результате которых компоненты, составляющие исходную смесь, отделяются один от другого. Процесс, в котором нужные компоненты выделяют в самостоятельную фазу или часть фазы, называется выделением.
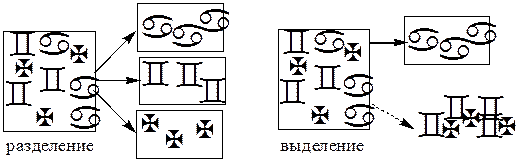
Концентрирование - процесс или операция повышения содержания определяемого вещества по отношению к матрице или матричным компонентам.
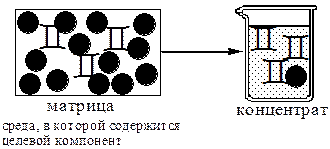
Концентрирование является частным случаем разделения. В основе этих операций лежат, как правило, одни и те же процессы. Различие между ними заключается в целях проведения. Цель разделения - упрощение способов определения интересующего нас вещества, цель концентрирования - снижение предела обнаружения (определения) вещества.
Для количественной характеристики эффективности разделения и концентрирования используют, соответственно, коэффициент разделения и коэффициент концентрирования. Рассмотрим, например, процесс разделения веществ, основанный на их различном распределении между двумя фазами. Отношение общих концентраций вещества в одной и второй фазах называется коэффициентом распределения (D).
Коэффициент разделения (KA/B) - это отношение коэффициентов распределения двух веществ.
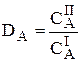
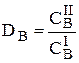
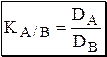
Разделение считается эффективным, если значение KA/B велико, а произведение DADB близко к 1.
Коэффициент концентрирования – величина, показывающая во сколько раз изменяется отношение абсолютных количеств микро - и макрокомпонента в концентрате по сравнению с исследуемой матрицей.
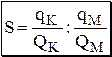
В настоящее время известны десятки различных методов разделения и концентрирования веществ. Единой и общепринятой их классификации нет. Обычно в качестве основного классификационного критерия используют наличие и характер фазовых переходов.
Методы разделения, основанные на различном межфазном распределении веществ, в которых одна из фаз является подвижной, а другая - неподвижной и процесс переноса вещества между ними происходит многократно, называются хроматографическими. Хроматографические процессы могут протекать в системе жидкость-жидкость (жидкость-жидкостная хроматография), жидкость - твёрдое вещество (адсорбционная хроматография, ионообменная хроматография и др.), газ - жидкость (газожидкостная хроматография) и т.д.