Устойчивость комплексных соединений зависит от природы комплексообразователя и лигандов. Так, устойчивость комплексов ионов d-элементов с различными лигандами изменяется в ряду
Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+
Данный ряд называется рядом устойчивости Ирвинга - Уильямса.
Закономерность изменения устойчивости многих комплексов металлов с различными лигандами можно объяснить с помощью теории жёстких и мягких кислот и оснований (ЖМКО) Р.Пирсона. Согласно данной теории кислоты и основания Льюиса разделяются на жёсткие и мягкие. Жесткие кислоты обладают конфигурацией внешнего электронного слоя s2p6 - такой же, как и благородные газы. Они имеют малый размер и низкую поляризуемость. К ним относится большинство катионов щелочных и щелочноземельных металлов, а также элементов главной подгруппы III группы периодической системы. Жесткими кислотами являются также катионы некоторых d-элементов с неполностью занятым d-подуровнем, например, Mn2+, Cr3+, Co3+, Ti4+. Самая жёсткая кислота - катион H+, который вообще не имеет электронной оболочки. К мягким кислотам относятся, как правило, катионы d-элементов в невысоких степенях окисления, например, Ag+, Hg2+, Hg22+, Cd2+ и т.п. Такие катионы имеют большой размер и легко поляризуются.
У оснований (лигандов) степень жёсткости зависит от их размера. Чем больше атом или соответствующий ему анион, тем легче он поляризуется и тем выше степень его «мягкости». Например, F- является жёстким основанием, Cl- - занимает промежуточное положение между жёсткими и мягкими основаниями, а Br - и I- относятся к мягким основаниям.
Мягкость кислот или оснований увеличивается по мере уменьшения абсолютной величины заряда иона. Например, Cu2+ является кислотой средней жёсткости, а Cu+ - мягкой. Cтепень «мягкости» катиона металла зависит и от природы связанного с ним лиганда. Например, ион Co2+ в аммиачном комплексе ведёт себя как жёсткая кислота, а в цианидном - как мягкая.
Согласно теории ЖМКО

Например, ионы Al3+, Be2+ «предпочитают» образовывать комплексы с O- и N- содержащими органическими лигандами (жёсткими основаниями). Для ионов Ag+ или Hg2+, наоборот, лучше подходят S-содержащие органические реагенты (мягкие основания).
Комплексы катионов металлов с полидентатными лигандами являются более устойчивыми, чем комплексы с аналогичными монодентатными лигандами. Данное явление называется хелатным эффектом. Хелатный эффект обычно объясняется тем, что реакция сольватированного катиона металла с хелатобразующим лигандом приводит к большему увеличению энтропии, чем реакция с монодентатным лигандом.
Комплексы металлов с макроциклическими лигандами (пример таких лигандов - краун-эфиры) более устойчивы, чем комплексы с аналогичными лигандами с открытой цепью. Данное явление называется макроциклическим, или суперхелатным эффектом.
Концентрация реагентов
Процесс образования комплексов, содержащих в своём составе более одного лиганда, протекает ступенчато, поэтому в растворе наряду со свободными ионами металла и свободным лигандом будут присутствовать несколько видов комплексов, представляющих собой результат присоединения к иону металла разного числа лигандов. Молярные доли этих комплексов, а также молярную долю свободных ионов металла можно рассчитать следующим образом.
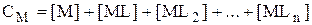

 ...
... 
 =
=
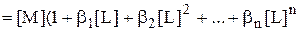




Пример 5.1. Рассчитать равновесные концентрации частиц Ag+ и [Ag(NH3)2]+ в растворе с общей концентрацией катионов серебра 1,0×10-2 моль/л и равновесной концентрацией NH3 1,0×10-3 моль/л.

 моль/л
моль/л

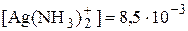 моль/л
моль/л
Сумма, стоящая в знаменателе выражений для расчёта a(M) и a(MLn), называется функцией закомплексованности - F(L). Она представляет собой отношение общей концентрации катиона металла к равновесной концентрации иона металла, не связанной в комплексы.

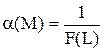
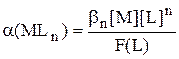
Значение F(L) может изменяться от 1 до  . Если комплексообразование отсутствует, то [M] = CM и F(L) = 1. Если же, наоборот, практически все ионы металла связаны в комплексы, то F(L) ®
. Если комплексообразование отсутствует, то [M] = CM и F(L) = 1. Если же, наоборот, практически все ионы металла связаны в комплексы, то F(L) ®  .
.
Отношение концентрации лиганда, вошедшего в комплексы, к общей концентрации ионов металла называется средним лигандным числом (функцией образования).

Среднее лигандное число показывает среднее число лигандов, связанных с ионом металла во всех образующихся при данных условиях комплексах или, для монодентатных лигандов, среднее координационное число центрального иона. Значение  может изменяться от 0, если комплексообразование отсутствует, до nмакс, если в растворе присутствует только один комплекс с максимально возможным для данного вида комплексов числом лигандов. В промежуточных случаях, когда в растворе находятся несколько комплексов, значение
может изменяться от 0, если комплексообразование отсутствует, до nмакс, если в растворе присутствует только один комплекс с максимально возможным для данного вида комплексов числом лигандов. В промежуточных случаях, когда в растворе находятся несколько комплексов, значение  может быть дробным. Значение среднего лигандного числа при некоторой величине [L] можно рассчитать следующим образом
может быть дробным. Значение среднего лигандного числа при некоторой величине [L] можно рассчитать следующим образом


Рис. 5.1. Распределительная диаграмма (1) и кривая образования (2) для аммиачных комплексов серебра
Зависимость молярных долей компонентов системы (свободных ионов металла и различных комплексов) от lg[L] (или -lg[L]) называется распределительной диаграммой для данных комплексов. Зависимость  от lg[L] (или -lg[L]) называется кривой образования комплекса (рис. 5.1).
от lg[L] (или -lg[L]) называется кривой образования комплекса (рис. 5.1).
Ионная сила
Концентрационная общая константа образования комплекса MLn связана с соответствующей термодинамической константой:
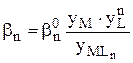
При увеличении ионной силы происходит уменьшение коэффициентов активности ионов - при этом числитель в выражении, связывающем термодинамическую и концентрационную константы, уменьшается в большее число раз, чем знаменатель. Таким образом, при повышении ионной силы и уменьшении коэффициентов активности ионов устойчивость комплекса уменьшается.
При использовании уравнения Дэвиса получаем, что

где  , I - не выше 0,5-0,7
, I - не выше 0,5-0,7
Влияние ионной силы на устойчивость комплекса зависит от заряда ионов, участвующих в равновесии комплексообразования. Если лиганд незаряжен, то заряд иона металла и заряд комплекса будут одинаковыми, Dnzi2 будет равно 0 и  . Если же в состав комплекса входят лиганды с большим зарядом и абсолютная величина заряда комплекса превышает заряд иона металла, то Dnzi2 < 0 и
. Если же в состав комплекса входят лиганды с большим зарядом и абсолютная величина заряда комплекса превышает заряд иона металла, то Dnzi2 < 0 и  .
.
Температура
Влияние температуры на процессы комплексообразования связано, во-первых, с влиянием на собственно константу образования комплекса и, во-вторых, на протекание побочных процессов (кислотно-основное взаимодействие, образование осадков, окисление лигандов или комплексообразователей кислородом воздуха и т.д.). Если при образовании комплекса DH > 0, то при повышении температуры устойчивость комплекса увеличивается, если DH < 0, то уменьшается. Чем больше абсолютное значение DH, тем сильнее влияет температура на константу образования комплекса.
Побочные реакции
На равновесие комплексообразования могут оказывать влияние различные побочные реакции, протекающие в растворе (кислотно-основное взаимодействие, образование других комплексов, осадков, окислительно-восстановительные процессы).
Влияние рН на устойчивость комплексов зависит от природы лиганда и центрального иона. Если в состав комплекса в качестве лиганда входит более или менее сильное основание (например, анион слабой кислоты, молекулы NH3, этилендиамина и т.п.), то при понижении рН происходит протонирование таких лигандов и уменьшение молярной доли формы лиганда, участвующей в образовании комплекса. Равновесие комплексообразования при этом смещается в сторону разрушения комплекса. Влияние рН будет в данном случае тем сильнее, чем больше сила данного основания и чем меньше устойчивость комплекса.
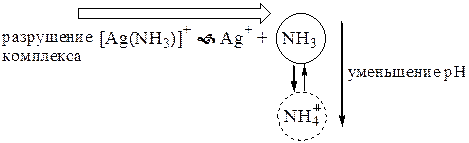
Если в состав комплексного соединения в качестве лиганда входит очень слабое основание (анион сильной кислоты), то уменьшение рН практически не будет сказываться на устойчивости комплекса (если, конечно, не учитывать изменение ионной силы раствора).
При повышении рН может происходить разрушение комплексов, связанное с образованием гидроксокомплексов и гидроксидов металлов. Влияние рН будет тем сильнее, чем больше устойчивость образующихся гидроксокомплексов и чем меньше растворимость образующегося осадка.
Если в растворах наряду с интересующей нас реакцией комплексообразования протекают различные побочные процессы, то для расчётов удобно использовать условные константы образования комплексов.
Пример 5.2. К раствору с концентрацией CaCl2 1,0×10-2 моль/л при рН 10,0 добавили равный объём 1,0×10-2 М динатриевой соли этилендиаминтетрауксусной кислоты (Na2H2Y). Чему равна равновесная концентрация Ca2+ в полученном растворе? b (CaY2-) = 5,0×1010.
Выражение для константы образования комплекса иона кальция с ЭДТА имеет следующий вид

 , так как Y4- + H3O+ › HY3- + H2O
, так как Y4- + H3O+ › HY3- + H2O
HY3- + H3O+ › H2Y2- + H2O и т.д.
Практически при рН 10 [Ca2+] = CЭДТА» [Y4-] + [HY3-]
 »
» 
Так как Ka6 = 5,5×10-11, то a = 0,35

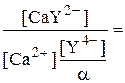
 = 1,75×1010
= 1,75×1010
 моль/л
моль/л
 моль/л
моль/л
5.5. Применение органических реагентов в аналитической химии
Органические реагенты - это органические соединения (мономерные или полимерные) различных классов, применяющиеся для качественного или количественного определения неорганических и органических веществ, а также для разделения, концентрирования, маскирования и других вспомогательных или предварительных операций, предшествующих и сопровождающих определение веществ любыми методами.
Одна из наиболее широких областей применения органических реагентов в аналитической химии - получение комплексных соединений с ионами металлов. Образующиеся продукты могут обладать ценными химико-аналитическими свойствами. Одни из них, например, интенсивно окрашены, причём характер окраски заметно отличается от окраски реагирующих веществ. Другие способны не только поглощать электромагнитное излучение видимого диапазона, но и отдавать его в виде флуоресцентного излучения. Третьи обладают очень малой растворимостью в воде и т.п.
Для того чтобы органическое соединение могло выступать в роли органического реагента, в составе его молекулы должна присутствовать определённая совокупность функциональных групп, называемая функционально-аналитической группировкой.
Функционально-аналитическая группировка - совокупность функциональных групп, превращающая органическое соединение в реагент на определённое вещество или группу веществ.
Например, вещества, в молекуле которых присутствует группа атомов (I), взаимодействуют с ионами Ni2+ с образованием малорастворимого хелата красного цвета.

Органические вещества в реакциях комплексообразования могут выступать в роли как монодентатных (например, пиридин), так и полидентатных лигандов. Большая часть комплексов металлов с полидентатными органическими лигандами являются хелатами.
Для того чтобы молекула органического вещества могла выступить в роли хелатообразующего лиганда, в её составе должно быть, по крайней мере, два электронодонорных гетероатома. Функциональные группы, участвующие во взаимодействии с ионом металла при образовании хелатов, можно разделить на два вида.

Группы, участвующие в образовании хелата, должны располагаться в молекуле таким образом, чтобы при их взаимодействии с ионом металла мог образоваться устойчивый цикл. Как правило, в состав хелатов входят пяти- либо шестичленные циклы (правило Л.А. Чугаева), реже четырёх- и семичленные. Образование таких циклов термодинамически наиболее выгодно, так как в них имеет место самое малое угловое напряжение.

Табл. 5.1.
Некоторые хелатобразующие органические реагенты
| Класс соединений | Примеры реагентов |
| Лиганды с одним типом донорных атомов О,О-лиганды | |
| гидроксихиноны | 
|
| b-дикетоны | 
|
| полифенолы | 
|
| фенолокислоты | 
|
| многоатомные спирты | 
|
| нитрозофенолы | 
|
| S,S-лиганды | |
| дитиолы | 
|
| производные дитиокарбаминовой кислоты | 
|
| N,N - лиганды | |
| диамины | 
|
| диоксимы | 
|
| N-содержащие гетероциклы | 
|
| Лиганды с разными донорными атомами О,S-лиганды | |
| меркаптокарбоновые кислоты | 
|
| N,S-лиганды | |
| гидразиды тиокарбоновых кислот | 
|
| амиды тиокарбоновых кислот | 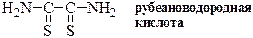
|
| O,N-лиганды | |
| производные 8-гидроксихинолина | 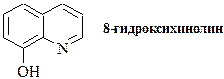
|
| аминокислоты | 
|
| полиаминокарбоновые кислоты | 
|
| гидразиды | 
|
Ниже показаны некоторые из видов хелатных циклов, образующихся при взаимодействии органических реагентов с ионами металлов. Цикл (1) образуют производные дитиокарбаминовой кислоты, (2) - о -дифенолы, (3) - вещества, содержащие a-диольную группировку, (4) - диоксимы, (5) - 1,2-диамины, (6) - дитизон и аналогичные соединения, (7) - 8-гидроксихинолин и его производные, (8) - аминокарбоновые кислоты, (9) - карбазиды, (10) - гидроксихиноны, (11) - хромотроповая кислота и её производные, (12) - b-дикетоны, (13) - салициловая кислота и её производные, (14) - о -нитрозофенолы.
четырёхчленные циклы

Пятичленные циклы


Шестичленные циклы

В табл. 5.2. показаны некоторые примеры использования хелатообразующих органических реагентов в аналитической химии.
Табл. 5.2.
Некоторые примеры использования хелатообразующих
органических реагентов в аналитической химии
| Область применения | Примеры реагентов |
| реакции обнаружения и идентификации | диметилглиоксим (Ni2+), дифенилкарбазид (Hg2+) |
| маскирование | ЭДТА, тартраты, цитраты |
| экстрагенты | дитизон, 8-гидроксихинолин |
| хроматография | b-дикетоны, 8-гидроксихинолин |
| осадители | 8-гидроксихинолин, диметилглиоксим |
| титранты | ЭДТА |
| индикаторы | мурексид, пирокатехиновый фиолетовый |
| фотометрия | тиомочевина, 1,10-фенантролин |
| флуориметрия | морин, 8-гидроксихинолин |
| компоненты ионоселективных электродов | краун-эфиры |
К химико-аналитическим свойствам органические реагентов в зависимости от целей их использования предъявляются различные требования. Например

Применение органических реагентов в аналитической химии не ограничивается реакциями комплексообразования. Некоторые реагенты образуют с определяемыми ионами простые соли, например
K+ + [(C6H5)4B]- ® K[(C6H5)4B]¯
тетрафенилборат
Известны органические реагенты, принимающие участие в окислительно-восстановительных реакциях, например, дифениламин, дифенилкарбазид, аскорбиновая кислота. Такие реагенты используются в качественном анализе, для маскирования мешающих ионов, как окислительно-восстановительные индикаторы и др. Иногда при взаимодействии органического реагента с определяемыми ионами образуются новые органические вещества с характерными химико-аналитическими свойствами, например

Некоторые органические реагенты участвуют в каталитических реакциях. Например, при окислении люминола (гидразида 3-аминофталевой кислоты) пероксидом водорода при рН> 8,5 возникает хемилюминесценция. Этот процесс катализируется микроколичествами некоторых металлов, например, Cu2+. Люминол используется для хемилюминесцентного определения катионов металлов.
ГЛАВА 6







