

Соединения, образующиеся при взаимодействии насыщенных по координационному числу внутрисферных комплексов и любых частиц, находящихся во внешней сфере, называются внешнесферными комплексами.
Например (внутрисферные комплексные частицы выделены полужирным шрифтом):
[(C4H9)N4]2 [Co(SCN)4]; [Ba(OH2)6]× RSO3;
[Сd(phen)2] (RCOO)2, (phen – фенантролин);

При образовании внешнесферного комплекса центральный ион не образует новой химической связи, взаимодействие происходит между лигандами внутренней сферы и частицами внешней сферы. Внешнесферные комплексы отличаются от обычных ионных пар (ионных ассоциатов) тем, что последние образуются в результате только электростатического взаимодействия полностью или частично сольватированных ионов, в то время как при образовании внешнесферных комплексов происходит образование ковалентной связи, водородной связи, имеет место ион-дипольное, гидрофобное взаимодействие и др.
Циклические комплексные соединения катионов металлов с полидентатными лигандами (обычно органическими), в которых центральный ион металла входит в состав одного или нескольких циклов, называются хелатами.

Ковалентные связи, образованные по донорно-акцепторному механизму, часто обозначают стрелкой ®, показывающей переход электронов от донорного центра лиганда к иону металла. Поскольку такие связи ничем не отличаются от обычных ковалентных связей, то их можно обозначать и простой чёрточкой.
Равновесия в растворах комплексных соединений
Внутренняя сфера связана с внешней ионной связью, поэтому в растворе соединение, содержащее комплексный ион, ведёт себя как сильный электролит. Например:
[Ag(NH3)2]NO3 ® [Ag(NH3)2]+ + NO3-
Между центральным ионом и лигандами образуются ковалентные связи по донорно-акцепторному механизму. Процесс комплексообразования происходит обратимо.
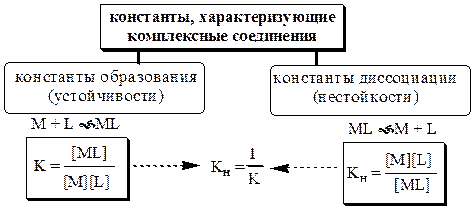
Обычно в состав комплексного соединения входит несколько лигандов, и процессы комплексообразования протекают ступенчато. Константы равновесия, характеризующие отдельную ступень, называются ступенчатыми (K). Произведение ступенчатых констант представляет собой общую константу (bn, n – число ступеней), например (табл. 5.1).
Табл. 5.1
Константы образования аммиачных комплексов серебра
| Комплекс | Ступенчатая константа образования | Общая константа образования |
| [Ag(NH3)]+ |  lgK1 = 3,32
lgK1 = 3,32
|
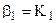
|
| [Ag(NH3)2]+ |  lgK2 = 3,91 lgK2 = 3,91
|  = =1,7×107
lgb2 = lg K1 + lgK2 = 7,23 = =1,7×107
lgb2 = lg K1 + lgK2 = 7,23
|
Чем больше величина константы образования (для однотипных комплексов!), тем выше устойчивость комплекса.
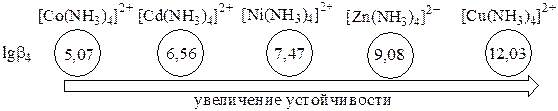
Наоборот, более устойчивому комплексу соответствует меньшая константа диссоциации
Константы, используемые для описания равновесий в растворах комплексных соединений, как и любые константы равновесия, могут быть термодинамическими и концентрационными (реальными и условными). Например, для комплекса MLn



Данные константы связаны между собой следующим образом


Константы равновесия характеризуют термодинамическую стабильность комплекса - меру возможности образования или диссоциации данного комплекса в равновесных условиях. Существует также понятие «кинетическая устойчивость», характеризующее скорость образования (диссоциации) комплексной частицы. В зависимости от скорости замещения лигандов внутренней сферы на другие лиганды комплексы разделяют на

5.4. Влияние различных факторов на комплексообразование в растворах
На процессы комплексообразования оказывают влияние природа комплексообразователя и лигандов, температура, ионная сила раствора, концентрация реагентов, а также побочные реакции, протекающие в растворе (протонирование лиганда при изменении рН, образование малорастворимых соединений и др.)






