Природа растворяемого вещества и растворителя
В настоящее время не существует точных правил или каких-то количественных закономерностей, позволяющих предсказать растворимость любого соединения в любом растворителе или хотя бы объяснить возможные случаи растворимости. Поэтому зависимость между химическим строением соединения и его растворимостью в различных растворителях приходится описывать с помощью эмпирических правил, которые обычно носят статистический характер (например, “подобное растворяется в подобном”). На растворимость влияют такие факторы как способность вещества к сольватации данным растворителем, способность растворённого вещества изменять структуру растворителя, кристаллическая модификация осадка, размер частиц осадка и т.д.
Температура
Для большинства малорастворимых электролитов при повышении температуры растворимость в воде увеличивается, что связано с подводом дополнительной энергии, компенсирующей энергию, необходимую для разрушения кристаллической решётки, и действием энтропийного фактора. Исключение составляют некоторые малорастворимые соединения кальция, магния, лития (рис. 6.3). Уменьшение растворимости при повышении температуры может быть связано с разрушением сольватных оболочек и т.д.

Рис. 6.3. Влияние температуры на растворимость (мг/100 г воды) CaCO3 (1) и PbSO4 (2).
Ионная сила
Увеличение ионной силы раствора приводит к уменьшению коэффициентов активности ионов и к повышению их концентрации в насыщенном растворе над осадком
Явление повышения растворимости малорастворимого электролита при повышении ионной силы раствора называется солевым эффектом.
Пример 6.3. Рассчитать растворимость иодата бария при ионной силе 0,050.
Для расчёта коэффициентов активности ионов при ионной силе 0,050 можно использовать расширенное уравнение Дебая-Хюккеля. Коэффициент а для иона Ba2+ равен 5, а для иона IO3- - 4. В результате расчётов получаем, что у(Ba2+) = 0,46; y(BrO3-) = 0,82.
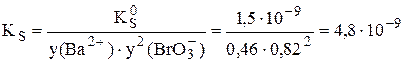
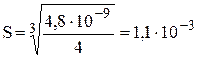 моль/л,
моль/л,
что примерно в 1,5 раза больше, чем при нулевой ионной силе.
Общий (одноименный) ион
Повышение активности в растворе одного иона, образующегося при растворении малорастворимого электролита, должно привести к уменьшению активности второго, так чтобы их произведение осталось неизменным. Если к раствору добавить некоторое количество хорошо растворимого электролита, содержащего такой же ион, что и малорастворимый электролит, то растворимость малорастворимого электролита уменьшится. Такое явление называется эффектом общего (одноименного) иона.
Пример 6.4. Рассчитать растворимость иодата бария в 5,0×10-2 М NaIO3.
Концентрация иодат-ионов, образовавшихся при растворении иодата бария, значительно меньше, чем 5,0×10-2 моль/л, поэтому можно принять, что 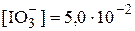 моль/л. Для расчётов воспользуется полученным в примере 6.3 концентрационным произведением растворимости иодата бария при I = 5,0×10-2.
моль/л. Для расчётов воспользуется полученным в примере 6.3 концентрационным произведением растворимости иодата бария при I = 5,0×10-2.
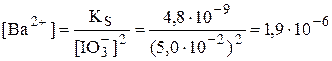 моль/л
моль/л
По сравнению с примером 6.3 растворимость иодата бария уменьшилась примерно на 3 порядка. Таким образом, влияние эффекта общего иона на растворимость сказывается значительно сильнее, чем влияние солевого эффекта.
При увеличении концентрации иона-осадителя растворимость осаждаемого иона уменьшается. Исходя из этого можно сделать неверное заключение о том, что при добавлении бесконечно большого его избытка растворимость интересующего нас соединения станет бесконечно малой. Молекулярная растворимость не зависит от концентрации иона осадителя в растворе. Она представляет собой предел, ниже которого растворимость осаждаемого соединения уменьшить при добавлении избытка иона-осадителя невозможно. В ряде случаев добавление значительного избытка общего иона приводит к повышению растворимости, например, за счёт протекания побочных реакций комплексообразования (рис. 6.4).
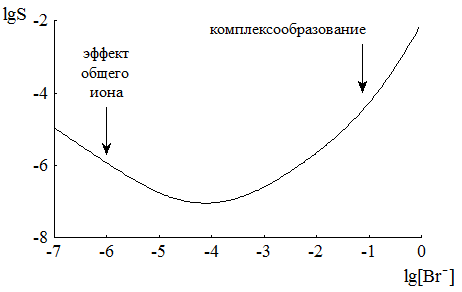
Рис. 6.4 Зависимость растворимости AgBr (размерность S - моль/л) от lg[Br-]
Для малорастворимых кислот и оснований одноименными ионами в водных растворах являются, соответственно, H3O+ и OH-.
Пример 6.5. При каком значении рН начнёт осаждаться Fe(OH)3 (KS = 6,3×10-38) из раствора с концентрацией Fe3+ 1,0×10-2 моль/л? При каком значении рН осаждение ионов железа можно считать полным?
Будем считать, что 1,0×10-2 М - это равновесная концентрация ионов Fe3+.
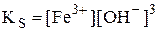
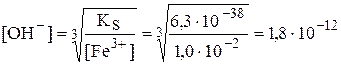 моль/л
моль/л
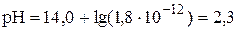
Осаждение считается полным, если остаточная концентрация осаждаемого иона в растворе становится меньше, чем 1×10-6 моль/л. Осаждение Fe3+ можно считать полным при рН > 3,6.
Побочные реакции
Ионы, образующиеся при растворении малорастворимого электролита, могут вступать в различные реакции с другими ионами, находящимися в растворе. В результате подобных реакций равновесие “осадок › насыщенный раствор” смещается в сторону преимущественного протекания процесса растворения, растворимость малорастворимого электролита увеличивается и при определённых условиях его можно будет практически полностью перевести в раствор.
Пример 6.6. Рассчитать растворимость оксалата бария при рН 4,0.
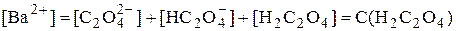
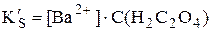
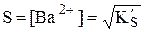
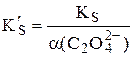
У щавелевой кислоты Ka1 = 5,6×10-2, Ka2 = 5,4×10-5. При рН 4,0 в растворе будут находиться оксалат- и гидрооксалат-ионы, концентрация неионизированных молекул щавелевой кислоты будет очень мала, поэтому
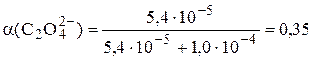
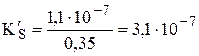
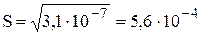 моль/л
моль/л
Величина рН в данном примере относится не к исходному раствору, в котором предполагается растворять оксалат бария, а к раствору, полученному в результате растворения. Исходная концентрация кислоты в растворе, в котором растворяли оксалат бария, была выше (либо это был буферный раствор с достаточно большой буферной ёмкостью). Это связано с тем, что при растворении оксалата бария и других электролитов, содержащих анионы, являющиеся основаниями, затрачиваются протоны. Если растворимость электролита невелика, то изменение рН будет небольшим, если же она достаточно большая, то и рН в процессе растворения заметно увеличится.
Пример 6.7. Рассчитать растворимость AgBr в 0,50 М NH3.
Как и в предыдущем примере вначале рассчитаем молярную долю иона, вступающего в побочную реакцию (в данном случае a(Ag+)), затем 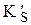 и, наконец, растворимость. Для аммиачных комплексов серебра: b1 = 2,1×103, b2 = 1,7×107. Будем считать, что
и, наконец, растворимость. Для аммиачных комплексов серебра: b1 = 2,1×103, b2 = 1,7×107. Будем считать, что 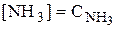 и что при такой большой концентрации лиганда в растворе преобладает комплекс [Ag(NH3)2]+.
и что при такой большой концентрации лиганда в растворе преобладает комплекс [Ag(NH3)2]+.
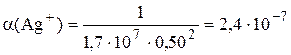
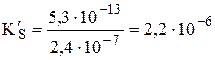
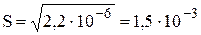 моль/л
моль/л






