Первая научная теория кислотности была предложена в 1780-х годах А. Лавуазье. Согласно данной теории все кислоты должны были обязательно содержать атом кислорода, что и было отражено в названии этого элемента.

В 1816 году Г. Дэви высказал предположение, что в состав кислот должен обязательно входить атом водорода. В 1833 году Ю. Либих уточнил это определение - кислота - вещество, в состав которого входят атомы водорода, способные замещаться атомами металла.
В 1880-х годах С. Аррениус и В. Оствальд предложили ионную теорию кислот и оснований, согласно которой

В 1923 году почти одновременно появились ещё 2 теории кислот и оснований. Автором первой были датский химик И.Н. Брёнстед и английский химик Т.М. Лоури, а второй – американский физикохимик Г.H. Льюис. Согласно теории Брёнстеда - Лоури, названной протолитической теорией кислот и оснований:
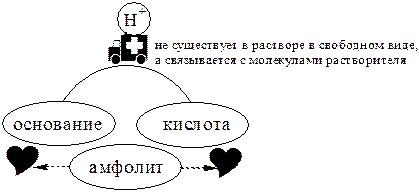
Кислоты, основания и амфолиты могут быть как электронейтральными, так и иметь заряд.

Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. Кислоты и основания существуют как сопряжённые пары. В процессе взаимодействия друг с другом кислота и основание не исчезают, например, образуя соль, а превращаются в новое основание и новую кислоту.

Понятие «соль» в протолитической теории вообще не используется и, тем более, отсутствует понятие «гидролиз соли». Так, например, тот факт, что раствор NH4Cl имеет слабокислую среду, объясняется не гидролизом данной соли с образованием слабого электролита NH4OH и сильного электролита HCl, а тем, что катион аммония является слабой кислотой. Более того, никакого «слабого электролита» NH4OH на самом деле не существует (связь между атомами кислорода и азота не может быть ковалентной, так как азот не бывает пятивалентным).
Согласно теории Льюиса, названной электронной теорией кислот и оснований
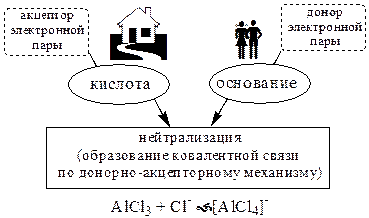
Основания Брёнстеда и основания Льюиса представляют собой одни и те же соединения, понятие «кислота» согласно протолитической и электронной теориям отличается.
В аналитической химии преимущественно используется протолитическая теория. Это связано с тем, что теория Льюиса имеет слишком общий характер и её трудно применить для количественных расчётов.
4.2. Количественное описание силы кислот и оснований
Для количественной характеристики силы кислот, находящихся в растворе, используют константу, характеризующую способность кислоты отдавать протон молекуле растворителя, выступающей в качестве основания. Такая константа называется константой кислотности (Ka).
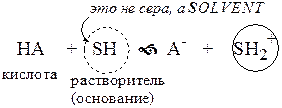



Активность растворителя не входит в выражение константы, так как считается равной 1.
Для водных растворов



Силу оснований можно описывать двояко: с помощью константы основности (Kb) либо с помощью константы кислотности сопряженной кислоты (KBH+ или Ka). В случае водных растворов данные константы описывают следующие равновесия:
B + H2O › BH+ + OH- BH+ + H2O › B + H3O+


Константа основности в современной аналитической химии практически не применяется. Это связано с тем, что при использовании данной константы, приходится работать с активностью (или концентрацией) гидроксид-ионов, в то время как среду раствора принято описывать с помощью концентрации ионов водорода. Кроме того, при использовании константы кислотности сопряжённой кислоты все протолиты (и кислоты и основания) можно объединить в одну таблицу. Константа основности не несёт никакой новой информации, так как её легко рассчитать, зная величину константы кислотности сопряжённой кислоты.
Обозначения KBH+ и Ka равнозначны между собой. Первый из них мы в дальнейшем будем использовать в тех случаях, когда речь идёт о характеристике силы основания через сопряжённую с ним кислоту. Это особенно удобно в случае сложных органических молекул, содержащих несколько кислотных и основных центров.
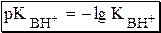

4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
Кислотно-основные свойства растворителя
Сила кислоты зависит от природы взаимодействующего с ней основания, а сила основания - от взаимодействующей с ним кислоты. Например, первичный амин в воде является более слабым основанием, чем в уксусной кислоте.
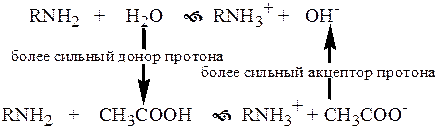


|
Протонизированным называют атом водорода, связанный с атомом сильно электроотрицательного элемента и способный легко отщепляться от молекулы в виде протона (поэтому иногда его называют «подвижным»).
В зависимости от кислотно-основных свойств растворители бывают:
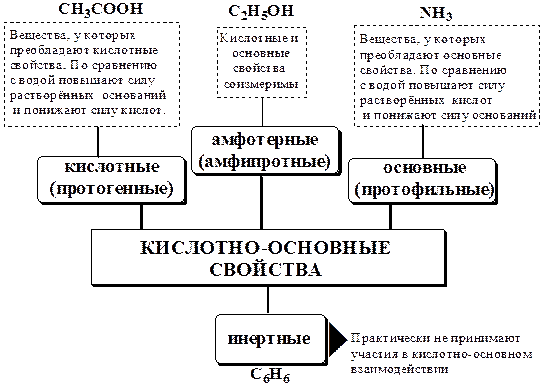
Протонные растворители могут относиться как к кислотным (уксусная кислота), так и к основным (аммиак) или амфотерным растворителям (вода). Одни из представителей полярных апротонных растворителей, например, диметилформамид, обладают основными свойствами, другие (кетоны, ацетонитрил, диметилсульфоксид), а также неполярные апротонные растворители вообще не склонны к реакциям кислотно-основного взаимодействия.
Автопротолиз растворителя. Константа автопротолиза
Автопротолизом называют процесс кислотно-основного взаимодействия между двумя молекулами вещества, при котором одна молекула ведёт себя как кислота, а вторая - как основание.
H2O + H2O › H3O+ + OH-
СH3COOH + СH3COOH › СH3COO- + СH3COOH2+
C2H5OH + C2H5OH › C2H5O- + C2H5OH2+
NH3 + NH3 › NH2- + NH4+
Автопротолизу в той или иной степени подвергается большинство растворителей. Однако у одних веществ он идёт более интенсивно, у других - менее интенсивно.
Рассмотрим реакцию кислотно-основного взаимодействия между двумя молекулами растворителя
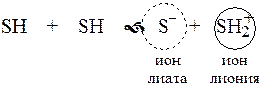
Для чистого растворителя  , поэтому
, поэтому

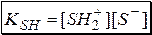
Полученная константа называется константой автопротолиза (KSH).

В случае воды выражения для константы автопротолиза (обычно обозначается как KW) выглядит следующим образом:


При 25 °С 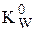 = 1,0×10-14, pKW = 14,0. При увеличении температуры константа автопротолиза воды увеличивается, а её показатель, соответственно, уменьшается.
= 1,0×10-14, pKW = 14,0. При увеличении температуры константа автопротолиза воды увеличивается, а её показатель, соответственно, уменьшается.
Показатель константы автопротолиза является мерой протяжённости шкалы кислотности (от 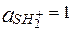 до
до  ) для данного растворителя. Величина, равная половине pKSH, соответствует нейтральной среде для данного растворителя. В нейтральной среде
) для данного растворителя. Величина, равная половине pKSH, соответствует нейтральной среде для данного растворителя. В нейтральной среде  .
.

Константа автопротолиза растворителя связывает между собой константы кислотности и основности частиц, образующих сопряжённую кислотно-основную пару. Например, для водных растворов:

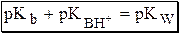
Диэлектрическая проницаемость
Диэлектрической проницаемостью среды (e) называют безразмерную величину, которая показывает, во сколько раз взаимодействие между двумя точечными электрическими зарядами в данной среде слабее, чем в вакууме.
Чем выше диэлектрическая проницаемость растворителя, тем лучше происходит диссоциация растворённого в нём электролита. Растворители, у которых e > 15, называются полярными, а те, у которых e < 15 - неполярными.
Диэлектрическая проницаемость влияет на величину константы автопротолиза.

Если растворитель имеет малую диэлектрическую проницаемость, то константа диссоциации ионной пары будет также мала, следовательно, и значение константы автопротолиза будет небольшим.
| растворитель | e | pKSH |
| HCOOH | 57,0 | 6,1 |
| CH3COOH | 6,2 | 14,4 |
Диэлектрическая проницаемость растворителя оказывает влияние на константу кислотности (или основности) растворённого вещества. При уменьшении e величины данных констант уменьшаются. Причём у заряженных частиц они изменяются менее сильно, чем у незаряженных.
| кислота | H2O | CH3OH | pKa |
| C6H5COOH | 4,2 | 9,5 | 5,3 |
| C6H5NH3+ | 4,6 | 6,1 | 1,5 |







