Дано:
c  = 0,05 М = 0,05 М
|
| pH -? |
РЕШЕНИЕ:
HOCl <=> H+ + OCl- (7.3)
HOCl - слабый электролит.
рН = - lg [H+]; [H+] = cНOСl·α·n  ,
,
n  - число Н+ образовавшихся при диссоциации одной молекулы HOCl, n
- число Н+ образовавшихся при диссоциации одной молекулы HOCl, n  = 1.
= 1.

КHOCl - константа диссоциации HOCl:
К  =5,0·10-8, (табл.),
=5,0·10-8, (табл.),
тогда 
c  = cНOСl·α·n
= cНOСl·α·n  = 5·10-2·10-3·1 = 5,0·10-5 моль/л,
= 5·10-2·10-3·1 = 5,0·10-5 моль/л,
тогда рН = - lg5,0·10-5 = 4,3.
Ответ: рН 0,05 М HOCl равно 4,3.
3. Определить произведение растворимости MgF2, если его растворимость в воде при 250С равна 1,17·10-3 моль/л.
Дано:
c 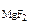 = 1,17·10-3 моль/л = 1,17·10-3 моль/л
|
ПР 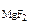 -? -?
|
РЕШЕНИЕ:
Равновесие между осадком малорастворимого электролита и его насыщенным раствором выражается уравнением:
MgF2(к) <=> Mg2+ (р) + 2F-(р) (7.4)
ПР 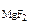 = [Mg2+ ]·[F-]2,
= [Mg2+ ]·[F-]2,
[Mg2+ ] = c 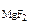 ·α·n
·α·n  , [F-] = c
, [F-] = c 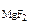 ·α·n
·α·n  .
.
MgF2 - сильный электролит, α = 1.
n  = 1, n
= 1, n 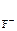 = 2 (из уравнения 7.4)
= 2 (из уравнения 7.4)
[Mg2+ ] = 1,17·10-3·1·1 = 1,17·10-3 моль/л,
[F-] = 1,17·10-3·1·2 = 2,34·10-3 моль/л.
Тогда ПР 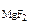 = 1,17·10-3·(2,34 10-3)2 = 6,41·10-9.
= 1,17·10-3·(2,34 10-3)2 = 6,41·10-9.
Ответ: ПР 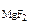 = 6,41·10-9
= 6,41·10-9
УРОВЕНЬ В
1. Рассчитать рН раствора, полученного смешением 25 см3 0,1М раствора HCl, 20 см3 0,2М раствора NaOH и 50 см3 воды.
Дано:
 = 20см3 = 20см3
 = 0,2 моль/л = 0,2 моль/л
 = 25см3 = 25см3
 = 0,1 моль/л = 0,1 моль/л
|
| рН -? |
РЕШЕНИЕ:
NaOH + HCl → NaCl + H2O (7.5)
Рассчитываем химическое количество исходных веществ:
 =
=  ·
·  = 0,2 ·20·10-3 = 4·10-3 = 0,004 моль,
= 0,2 ·20·10-3 = 4·10-3 = 0,004 моль,
 =
=  ·
·  = 0,1·25·10-3 = 2,5·10-3 = 0,0025 моль
= 0,1·25·10-3 = 2,5·10-3 = 0,0025 моль
10-3 – коэффициент перевода мл в л.
Из уравнения реакции (7.5) следует, что число моль NaOH, вступившего в реакцию, равно числу моль HCl.
Определяем вещество, оставшееся в избытке:
0,004 моль > 0,0025 моль.
Следовательно, в избытке, который определяет рН среды остался NaOH.
Тогда количество избыточного NaOH в растворе:
 = 0,004 - 0,0025 = 0,0015 моль.
= 0,004 - 0,0025 = 0,0015 моль.
Учитывая, что суммарный объем раствора складывается из объемов двух растворов и воды,
 =
=  +
+  +
+ 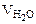 = 25·10-3 + 20·10-3 + 50·10-3 = 95·10-3л,
= 25·10-3 + 20·10-3 + 50·10-3 = 95·10-3л,
Молярная концентрация NaOH равна:
 =
=  = 0,016 моль/л.
= 0,016 моль/л.
Так как диссоциация NaOH протекает по уравнению:
NaOH = Na+ + OH-, то
 = 0,016 моль/л.
= 0,016 моль/л.
рОН = - lg  = - lg 0,016 = 1,80.
= - lg 0,016 = 1,80.
рН = 14 – рОН,
рН = 14-1,80 = 12,20.
Ответ: рН = 12,20.
2. Определить, образуется ли осадок, если смешали 100 см  0,01М водного раствора хлорида кальция и 200 см
0,01М водного раствора хлорида кальция и 200 см  0,02М водного раствора карбоната натрия.
0,02М водного раствора карбоната натрия.
Дано:
с  = 0,01M
с = 0,01M
с  = 0,02M
V = 0,02M
V  = 100 cм = 100 cм  V
V  = 200 cм = 200 cм 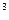
|
| Образуется ли осадок? |
РЕШЕНИЕ:
При смешении растворов протекает следующая реакция:
СaCl2+Na2CO3= CaCO3↓+ NaCl (7.6)
Осадок CaCO  образуется только в случае, если
образуется только в случае, если
с  ·с
·с  >ПР
>ПР  =5·10
=5·10  (табл.)
(табл.)
Поскольку смешали 100 cм 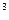 раствора CaCl
раствора CaCl 
 и 200 cм
и 200 cм 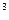 Na
Na  CO
CO  , то объем раствора после смешения составляет 300 cм
, то объем раствора после смешения составляет 300 cм 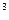 . После смешения с учетом разбавления растворов концентрации ионов Ca2+ и CO
. После смешения с учетом разбавления растворов концентрации ионов Ca2+ и CO  2- будут равны:
2- будут равны:
с  =
=  с
с  ·
·  ·n
·n  ; с
; с  =
=  с
с  ·
·  ·n
·n 
CaCl  и Na
и Na  CO
CO  - сильные электролиты,
- сильные электролиты,  = 1.
= 1.
Процессы диссоциации CaCl  и Na
и Na  CO
CO  протекают по следующим уравнениям:
протекают по следующим уравнениям:
CaCl  = Ca
= Ca  +2Cl
+2Cl 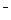
Na  CO
CO  = 2Na
= 2Na 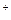 +CO
+CO 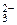
следовательно, n  = 1 и n
= 1 и n  = 1.
= 1.
с  =
=  0,01·1·1 = 3,3·10
0,01·1·1 = 3,3·10  моль/л,
моль/л,
с  =
=  0,02·1·1 = 1,3·10
0,02·1·1 = 1,3·10 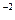 моль/л.
моль/л.
с  ·с
·с  = 3,3·10
= 3,3·10  ·1,3·10
·1,3·10 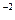 = 4,29·10
= 4,29·10 
Так как 4,29·10-5 > 5·10-9 (ПР  ), то осадок CaCO
), то осадок CaCO  образуется.
образуется.
Ответ: осадок CaCO  образуется.
образуется.
3.Вычислить рН 0,0IM водного раствора HNO2, содержащего, кроме того, 0,02 моль/л KNO2.
Дано:
с  = 0,01 M
с = 0,01 M
с 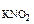 = 0,02 M = 0,02 M
|
| рН -? |
РЕШЕНИЕ:
рН = - lg с 
HNO2 <=> H+ + NO  (7.7)
(7.7)
KNO2 = K+ + NO  (7.8)
(7.8)

Прибавление KNO2 к раствору HNO2 смещает равновесие диссоциации HNO2 влево за счет увеличения концентрации иона NO2-. В результате, в системе устанавливается равновесие при новых концентрациях Н+ и NO  , но значение константы диссоциации HNO2 при этом остается прежним.
, но значение константы диссоциации HNO2 при этом остается прежним.
Тогда обозначим равновесную концентрацию ионов [Н+] в новых условиях через х:
[H+] = х моль/л.
Общая равновесная концентрация иона [NO  ] равна сумме концентраций иона NO
] равна сумме концентраций иона NO  , образовавшегося при диссоциации HNO2 и при диссоциации KNO2:
, образовавшегося при диссоциации HNO2 и при диссоциации KNO2:
[NO  ] = с
] = с 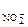 + с
+ с 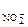 .
.
из HNO2 из KNO2
Концентрация ионов NO  , образовавшихся при диссоциации HNO2, равна х моль/л, так как при диссоциации 1 моль HNO2 образуется 1 ион Н+ и 1 ион NO
, образовавшихся при диссоциации HNO2, равна х моль/л, так как при диссоциации 1 моль HNO2 образуется 1 ион Н+ и 1 ион NO  (из уравнения 7.7).
(из уравнения 7.7).
Концентрация ионов NO  , образовавшихся при диссоциации КNO2 равна: с
, образовавшихся при диссоциации КNO2 равна: с 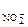 = с
= с 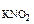 ·α·n
·α·n  = 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
= 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
КNO2 - сильный электролит, α = 1, n 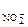 = 1.
= 1.
тогда [NO  ] = (х + 0,02) моль/л
] = (х + 0,02) моль/л
Равновесная концентрация недиссоциированных молекул
[HNO2] = (0,01 – х) моль/л.
 = 4·10-4, (табл.)
= 4·10-4, (табл.)
так как, х << 0,01 моль/л, то значением х, ввиду его малого значения, в выражениях (х+0,02) и (0,01- х) можно пренебречь, и данное выражение записать в виде:
 ; откуда х = [H+] = 2 · 10-4 моль/л
; откуда х = [H+] = 2 · 10-4 моль/л
рН = -lg(2·10-4) = 3,7
Ответ: рН = 3,7
ГИДРОЛИЗ СОЛЕЙ
УРОВЕНЬ А
1. Написать ионно-молекулярные и молекулярные уравнения гидролиза солей:
а) сульфата хрома (III) (Cr2(SO4)3),
б) сульфида натрия (Na2S)






