УРОВЕНЬ А
1. Используя справочные данные по 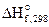 и
и  , определить температурную границу возможного технического использования карботермического процесса: PbO(к) + C(к) < = > Pb(к) + CO(г)
, определить температурную границу возможного технического использования карботермического процесса: PbO(к) + C(к) < = > Pb(к) + CO(г)
Записать выражение для константы равновесия Кр
| Дано: Уравнение реакции | РЕШЕНИЕ: Приведенный процесс будет возможен, когда равновесное давление оксида углерода (II) будет равно наружному давлению или превышать его, т.е. РСО = 1 |
| Т -? |
При равновесии 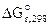 = 0, тогда КР = РСО = 1, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения:
= 0, тогда КР = РСО = 1, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения:
- 2,303RT lgKP = 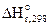 – Т·
– Т· 
Так как lgKP = lg1 = 0, то 0 = 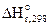 ·1000 – Т ·
·1000 – Т · 
Откуда 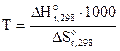
где 1000 – коэффициент перевода кДж в Дж
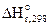 и
и  определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение (12.1):
определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение (12.1):
PbO(к) + C(к) < = > Pb(к) + CO(г) (12.1)
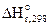 -219,3 0 0 -110,5
-219,3 0 0 -110,5
кДж/моль
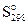 66,1 5,7 64,9 197,5
66,1 5,7 64,9 197,5
Дж/мольК
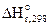 = -110,5 – (-219,3) = 108,8 кДж
= -110,5 – (-219,3) = 108,8 кДж
 = 197,5 + 64,9 – 5,7 – 66,1 = 190,6 Дж/К
= 197,5 + 64,9 – 5,7 – 66,1 = 190,6 Дж/К
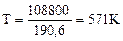
Ответ: процесс возможен при нагревании начиная с Т = 571К
При взаимодействии 7,27 г смеси, состоящей из оксида цинка с цинком, с водным раствором щелочи выделилось 1,12 л водорода (н.у.). Написать уравнения протекающих процессов. Вычислить массовую долю оксида цинка в смеси.
Дано:
Смесь Zn и ZnO
 = 7,27 г
Vо ( = 7,27 г
Vо (  ) = 1,12 л ) = 1,12 л

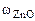 -? -?
| РЕШЕНИЕ:
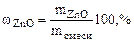
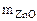 = = 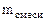 - - 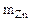 ZnО + H2О + 2NaOH = Na2[Zn(OH)4] (12.2)
Zn о+2
ZnО + H2О + 2NaOH = Na2[Zn(OH)4] (12.2)
Zn о+2 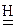   +2NaOH=Na2[ Zn +2(OH)4] + +2NaOH=Na2[ Zn +2(OH)4] + 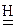 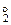 (12.3) (12.3)
|

 НОК ДМ
НОК ДМ
Znо – 2e = Zn+2 1
H+ + e = Hо 2
 |
Zn + 2H+ = Zn+2 + 2Hо
Поскольку водород выделяется только при взаимодействии цинка с водным раствором щелочи, то массу цинка определяем из уравнения реакции (12.3):
Составляем пропорцию:
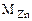 вытеснит 22,4 л Н2
вытеснит 22,4 л Н2
 65,4 г Zn 22,4 л Н2
65,4 г Zn 22,4 л Н2

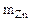 1,12 л Н2
1,12 л Н2
где 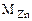 = 65,4 г/моль
= 65,4 г/моль
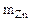 =
= 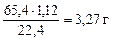
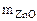 =
= 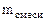 -
- 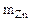 = 7,27 – 3,27 = 4 г
= 7,27 – 3,27 = 4 г
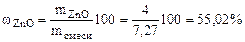
Ответ:  .
.
Используя значения стандартных электродных потенциалов, рассчитать константу равновесия в реакции цементации, протекающей при стандартных условиях.
CuSO4(р) + Fe(к) < = > FeSO4(р) + Cu(к)
Записать выражение для константы равновесия
Дано:
Уравнение реакции
 Кс -?
Кс -?
| РЕШЕНИЕ Записываем реакцию в ионно- молекулярном виде: |
Feo(к) + Cu2+(р) + SO 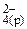 <=> Fe2+(р) + SO
<=> Fe2+(р) + SO 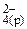 + Cuo(к) – полное ионно-молекулярное уравнение
+ Cuo(к) – полное ионно-молекулярное уравнение
Cu2+(р) + Feo(к) < = > Fe2+(р) + Cuo(к) – сокращенное ионно-молекулярное уравнение
НОК ДМ

 окис-ль Сu2+ + 2ē = Cu 1
окис-ль Сu2+ + 2ē = Cu 1 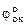 = 0,34В (табл. 11.1)
= 0,34В (табл. 11.1)
 восст-ль Feo - 2ē = Fe2+ 1
восст-ль Feo - 2ē = Fe2+ 1 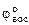 = -0,44В (табл. 11.1)
= -0,44В (табл. 11.1)
Cu2+ + Feo = Cuo + Fe2+ - стандартное напряжение этой реакции
εo = 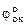 -
- 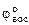 ; εo = 0,34 - (-0,44) = 0,78В
; εo = 0,34 - (-0,44) = 0,78В
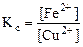
Так как приведенная реакция является окислительно-восстановительной, то:
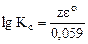 ;
; 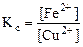 =
= 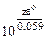 , где z - НОК
, где z - НОК
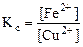 =
= 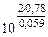 = 1026
= 1026
Ответ: Кс = 1026. Высокое значение Кс свидетельствует о практически полном смещении равновесия вправо.
УРОВЕНЬ В
1. На 2 г смеси, состоящей из Fe, FeO, Fe2O3 подействовали хлороводородной кислотой. При этом выделилось 224 см3 (при н.у.) водорода, а при восстановлении 2 г исходной смеси до металла водородом получено 0,45 г воды. Определить состав исходной смеси (% масс.).
Дано:
Mсмеси = 2 г
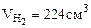
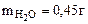
| РЕШЕНИЕ: При взаимодействии смеси с хлороводородной кислотой протекают следующие реакции: FeO + 2HCl = FeCl2 + H2O (12.4) Fe2O3 + 6HCl = 2FeCl3 + 3H2O (12.5) Водород выделяется лишь за счет реакции: Fe + 2HCl = FeCl2 + H2↑ (12.6) |
ω 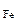 -? ω -? ω 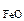 -?
ω -?
ω 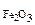 -? -?
|
Cоставляем пропорцию для реакции (12.6):
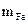 вытесняет 0,224 л H2
вытесняет 0,224 л H2
56 г Fe вытесняет 22,4 л Н2
откуда
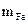 =
= 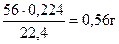
где
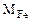 = 56 г/моль
= 56 г/моль
Масса оксидов равна:
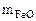 +
+ 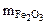 = 2 – 0,56 = 1,44 г
= 2 – 0,56 = 1,44 г
При восстановлении смеси FeO и Fe2O3 водородом протекают реакции
FeO + H2 = Fe + H2O (12.7)
Fe2O3 + 3H2 = 2Fe + 3H2O (12.8)
Составляем пропорцию для уравнения (12.7)
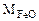 -
-  72 г/моль - 18 г/моль
72 г/моль - 18 г/моль
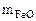 -
- 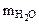
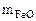 -
- 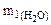
Откуда 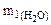 =
= 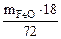 = 0,25
= 0,25 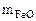
Составляем пропорцию для уравнения (12.8)
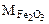 -
- 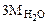 160 г/моль - 3·18 г/моль
160 г/моль - 3·18 г/моль
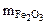 -
- 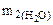
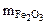 -
- 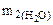
Откуда 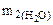 =
= 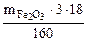 = 0,337
= 0,337 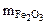
По условию задачи
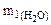 +
+ 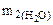 = 0,25
= 0,25 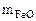 + 0,337
+ 0,337 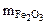 = 0,45 г
= 0,45 г
Составляем систему уравнений
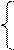
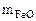 +
+ 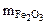 = 1,44 г
= 1,44 г
0,25 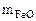 + 0,337
+ 0,337 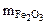 = 0,45 г
= 0,45 г
Выражаем из первого уравнения 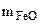
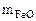 = 1,44 -
= 1,44 - 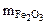 и подставляем во второе уравнение
и подставляем во второе уравнение
0,25·(1,44 - 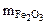 ) + 0,337
) + 0,337 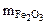 = 0,45 г
= 0,45 г
0,09 = 0,087 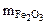
Откуда 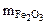 = 1,03 г, а
= 1,03 г, а 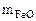 = 1,44 – 1,03 = 0,41 г
= 1,44 – 1,03 = 0,41 г
Определяем состав исходной смеси:
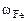 =
= 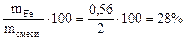
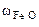 =
= 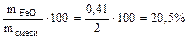
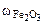 =
= 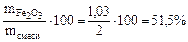
Ответ: состав смеси: 28% - Fe, 20,5% - FeO, 51,5% - Fe2O3
2. Составить схему получения металлического кадмия из 10 г смеси оксидов CdO и ZnO. В качестве растворителя оксидов использовать разбавленную серную кислоту. Определить состав смеси (% мас.) и массу полученного кадмия, если в качестве восстановителя CdO использовали СО, а объем образовавшегося СО2 составляет 300 см3 (н.у.)
Дано:
M  = 10 г
V = 10 г
V  = 300 см3 = 300 см3
| РЕШЕНИЕ: Составляем схему разделения оксидов и записываем уравнения реакций по стадиям: 1. Растворение оксидов кадмия и цинка в H2SO4: CdO + H2SO4 = CdSO4 + H2O (12.9) ZnO + H2SO4 = ZnSO4 + H2O (12.10) |
ω 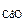 -? ω -? ω 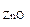 -?
m -?
m 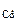 -? -?
|
2. Осаждение гидроксидов кадмия и цинка гидроксидом натрия при стехиометрическом соотношении солей и гидроксида натрия:
CdSO4 + 2NaOH = Cd(OH)2↓ + Na2SO4 (12.11)
ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4 (12.12)
3. Растворение амфотерного гидроксида цинка в избытке щелочи:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] (12.13)
избыток растворимая соль
Так как Na2[Zn(OH)4] - растворимая соль, то в осадке остается только гидроксид кадмия.
4. Отделение осадка Cd(OH)2 от раствора фильтрацией, промывка, сушка.
5. Разложение осадка Cd(OH)2 при нагревании:
Cd(OH)2 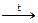 СdO + H2O↑ (12.14)
СdO + H2O↑ (12.14)
6. Восстановление CdO оксидом углерода (II) при нагревании:
CdO + CO 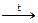 Cd + CO2 (12.15)
Cd + CO2 (12.15)
М 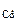 - 22,4 л
- 22,4 л
m 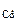 - V0(СО2)
- V0(СО2)
откуда m 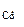 =
= 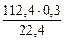 = 1,5 г
= 1,5 г
где М 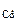 = 112,4 г/моль
= 112,4 г/моль
Определяем содержание СdO в смеси по уравнению (12.16)
M 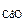 ― M
― M 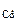
m 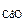 ― m
― m 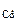
128,4г ― 112,4 г
m 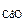 ― 1,5 г
― 1,5 г
где M 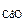 = 128,4 г/моль,
= 128,4 г/моль,
откуда m 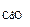 =
= 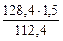 = 1,71 г
= 1,71 г
Определяем ω 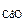 =
= 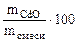 =
= 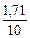 ·100 = 17,1%
·100 = 17,1%
ω 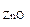 = 100 – 17,1 = 82,9%
= 100 – 17,1 = 82,9%
Ответ: состав смеси ZnO - 82,9%, CdO - 17,1%, m 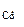 = 1,5 г.
= 1,5 г.
3. При растворении 0,5 г алюминиевой бронзы, состоящей из меди и алюминия, в хлороводородной кислоте выделилось 43,56 см3 водорода, собранного над водой и измеренного при 300К и 740 мм рт. ст. Давление паров воды при 300К равно 26,74 мм рт. ст. Определить состав сплава (% мас.)
Дано:
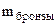 = 0,5 г
HCl - растворитель
V = 0,5 г
HCl - растворитель
V  = 43,56 см3
Т = 300 К
Р = 740 мм рт.ст.
Р = 43,56 см3
Т = 300 К
Р = 740 мм рт.ст.
Р  = 26,74 мм рт.ст. = 26,74 мм рт.ст.
|
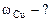
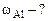
|
РЕШЕНИЕ:
В соответствии со следствием из ряда стандартных электродных потенциалов металлов в хлороводородной кислоте могут растворяться только те металлы, у которых
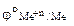 < 0.
< 0.
Определяем стандартные электродные потенциалы:
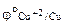 = + 0,34В,
= + 0,34В,
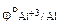 = -1,67В
= -1,67В
Следовательно, в хлороводородной кислоте из сплава будет растворяться только алюминий.
Уравнение реакции имеет вид:
Alo + HCl = Al+3Cl3 + H 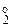 ↑ (12.17)
↑ (12.17)


 НОК ДМ ДМ
НОК ДМ ДМ
Alo - 3e = Al+3 1 2 ДМ удваиваем, т.к.
3 после реакции образуется
H+ + e = H о 3 6 четное число атомов
водорода 
2Al + 6H+ = 2Al3+ + 6Hо
2Al + 6HCl = 2AlCl3 + 3H2↑ (12.18)
Массу алюминия в сплаве можно рассчитываем по уравнению реакции (12.18):
2 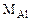 - 3·22400 см3 Н2
- 3·22400 см3 Н2
 -
- 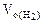
Откуда
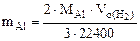 (12.19)
(12.19)
где 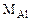 =27 г/моль
=27 г/моль
Объем водорода при н.у. (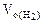 ) рассчитываем по объединенному уравнению газового состояния:
) рассчитываем по объединенному уравнению газового состояния:
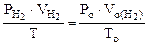
Откуда: 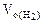 =
= 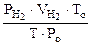 =
=
= 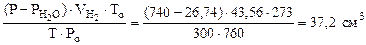
где 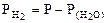
Подставляя величину 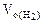 в формулу (12.19), получаем:
в формулу (12.19), получаем:
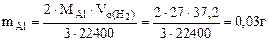
Рассчитываем содержание металлов в сплаве:
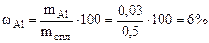
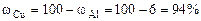
Ответ: состав сплава Al – 6%, Cu – 94%.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
УРОВЕНЬ А
1. Определить заряд комплексного иона, степень окисления и координационное число комплексообразователя в каждом из соединениях K4[Mo(CN)8], [PtCl4(NH3)2].






