(4) Fe2O3(к) + 3CO (г) = 2Fe (к) + 3СО2(г) (4.13)
| Дано: Термохимические уравнения трех реакций |
 заданной реакции -? заданной реакции -?
|
РЕШЕНИЕ:
Комбинируя уравнения (4.10),(4.11) и (4.12), необходимо получить искомое уравнение.
Для этого следует:
1. Определить искомое и заданные уравнения.
Искомое уравнение (4.13), а заданные - (4.10),(4.11) и (4.12).
2. Искомое уравнение получим путем сложения предварительного подготовленных заданных уравнений.
3. Предварительная подготовка заданных уравнений заключается в:
а) условном исключении из заданных уравнений тех участников реакции, которые отсутствуют в искомом уравнении:
б) умножении заданных уравнений и их тепловых эффектов на числа, которые позволяют получить коэффициенты, стоящие перед теми же веществами в искомой реакции:
в) умножении заданных реакций и тепловых эффектов на (-1) в случае, если для получения искомого уравнения необходимо перенести вещества заданной реакции вправо или влево от знака равенства.
4. Складываем левые и правые части предварительно подготовленных заданных уравнений и их тепловые эффекты.
Для решения задачи в первом термохимическом уравнении приводим в соответствие коэффициенты, необходимые для получения искомого уравнения. Для этого уравнение (4.10) умножаем на 3/2, получаем:
3CO(г) + 3/2 О2(г) = 3CO2(г) (4.14)
Заданное уравнение (4.11) умножаем на (-1), т.к. в искомом уравнении 2Fe (к) стоят в правой части уравнения, а в заданном в левой части уравнения, в результате получаем:
-2Fe(к) - O2(г) = -2FeO(к) (4.15)
Заданное уравнение (4.11) умножаем на (-1/2), т.к. в искомом уравнении имеем 1 моль Fe2O3(к), который находится в левой части уравнения, а в заданном 2 моль Fe2O3, находится в правой части уравнения, в результате получаем:
-2FeO(к) - ½О2(г) = -Fe2O3(к) (4.16)
Складываем левые и правые части уравнений (4.14), (4.15),(4.16):
3CO (г) + 3/2 О2(г) - 2Fe (к) + O2(г) - 2FeO (к) - ½О2(г) =
= 3CO2(г) -2FeO (к) - Fe2O3(к)
После сокращения получим:
3CO (г) - 2Fe (к) = 3CO2 (г) - Fe2O3(к)
Перенесем значения со знаком минус из левой части в правую, а из правой в левую часть уравнения получаем уравнение (4.13):
3CO (г) + Fe2O3(к) = 3CO2 (г) + 2Fe (к)
Значение изменения стандартной энтальпии реакции вычислим путем сложения изменений стандартных энтальпий реакций (4.14), (4.15), (4.16), умноженных на те же коэффициенты.
 =(-566) · 3/2 + (-529,6) · (-1) + (-585,2) · (-1/2) =-26,8 кДж
=(-566) · 3/2 + (-529,6) · (-1) + (-585,2) · (-1/2) =-26,8 кДж
Ответ:  = - 26,8 кДж
= - 26,8 кДж
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
УРОВЕНЬ А
1. Реакция между веществами А и В выражается уравнением: А(Г) + 2В(Г) = 2С(Г). Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ с  = 0,4 моль/л, с
= 0,4 моль/л, с  = 0,8 моль/л. Вычислить начальную скорость реакции и определить, во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.
= 0,8 моль/л. Вычислить начальную скорость реакции и определить, во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.

| РЕШЕНИЕ:
В простейших одностадийных реакциях скорость пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в уравнении реакции:
 = k· = k·  · ·  (5.1) (5.1)
 = k·C = k·C  · ·  = 0,1∙0,4·0,82 = =0,0256 моль/(л∙с).
Уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, так = 0,1∙0,4·0,82 = =0,0256 моль/(л∙с).
Уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, так
|
как исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции:
1моль А – 2 моль В
0,1 моль А – х моль В
х = 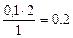 моль.
моль.
Тогда  = 0,1(0,4-0,1)(0,8-0,2)2 = 0,0108 моль/(л·с).
= 0,1(0,4-0,1)(0,8-0,2)2 = 0,0108 моль/(л·с).
В связи с уменьшением концентрации реагирующих веществ в ходе реакции скорость реакции уменьшается:

 =
=  .
.
Ответ:  = 0,0256 моль/(л∙с).
= 0,0256 моль/(л∙с).
При уменьшении концентрации вещества А на 0,1 моль/л скорость реакции уменьшилась в 2,37 раза.
2. Как изменится скорость реакции:
2CO(Г) + O2(Г) = 2CO2(Г), если: а) уменьшить давление в системе в 2 раза; б) уменьшить объем системы в 3 раза?
 | РЕШЕНИЕ:
На основании закона действующих масс
 = k· = k·  · ·  (5.2)
а) уменьшение давления в системе в 2 раза равносильно уменьшению концентраций реагирующих веществ во столько же раз.
Следовательно: (5.2)
а) уменьшение давления в системе в 2 раза равносильно уменьшению концентраций реагирующих веществ во столько же раз.
Следовательно:
|
 = k·
= k· 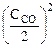 ·
·  =
=  ·
·  · k·(
· k·( ·
·  =
= 
 .
.
Тогда:
 =
=  .
.
б) уменьшение объема в системе в 3 раза равносильно увеличению концентрации реагирующих веществ во столько же раз:
 = k·(3
= k·(3  )2·(3
)2·(3  ) = 32·3·k·(
) = 32·3·k·( ·
·  = 27
= 27  .
.
Тогда:  = 27.
= 27.
Ответ: а) при уменьшении давления в 2 раза скорость реакции уменьшится в 8 раз; б) при уменьшении объема системы в 3 раза скорость реакции увеличится в 27 раз.





 уменьшается
на 0,1 моль/л
уменьшается
на 0,1 моль/л

