1. Все процессы, начинающиеся в точке «0» на исходной изохоре  =
=  (например, процессы 0-1 или 0-2, рис. 2.11) и идущие вправо от нее, совершаются с увеличением удельного объема
(например, процессы 0-1 или 0-2, рис. 2.11) и идущие вправо от нее, совершаются с увеличением удельного объема  (
( ), т.е. газ совершает работу расширения против внешних сил
), т.е. газ совершает работу расширения против внешних сил  , т.к.
, т.к.  .
.

|
| Рис. 2.11 |
Процессы, исходящие из точки «0», например, 0-3 и 0-4, и лежащие левее исходной изохоры, протекают с уменьшением  (
( ). Здесь к газу подводится работа извне, за счет чего он сжимается.
). Здесь к газу подводится работа извне, за счет чего он сжимается.
2. Во всех процессах, начинающихся в точке «0», лежащей на исходной изотерме Т 0 (рис. 2.12), например, в процессах 0-1 или 0-2, которые протекают вправо от исходной изотермы, температура газа увеличивается ( ), поэтому его внутренняя энергия возрастает (
), поэтому его внутренняя энергия возрастает ( ). В процессах 0-3 или 0-4, наоборот, Δ Т < 0 и (Δ u < 0).
). В процессах 0-3 или 0-4, наоборот, Δ Т < 0 и (Δ u < 0).

| 
|
| Рис. 2.12 | Рис. 2.13 |
3. Рассмотрим два процесса расширения газа (рис. 2.13):
- 0-1 – адиабатный, в котором q =0;
- 0-2 – изотермический, в котором  , поэтому
, поэтому  .
.
В соответствии с первым законом термодинамики  в изотермическом процессе 0-2 газ расширяется (υ > 0), совершая работу
в изотермическом процессе 0-2 газ расширяется (υ > 0), совершая работу  , за счет подвода к нему теплоты. Поэтому в этом процессе q > 0.
, за счет подвода к нему теплоты. Поэтому в этом процессе q > 0.
Таким образом, все процессы, начинающиеся в точке «0» на адиабате и протекающие вправо от адиабаты, совершаются с подводом к газу теплоты (q > 0), а процессы, протекающие влево от адиабаты – с отводом от газа теплоты.
Лекция 3. Второй закон термодинамики
Обратимые и необратимые процессы
Одним из важнейших понятий термодинамики является понятие об обратимых и необратимых процессах.
Процесс перехода системы из состояния 1 в состояние 2 является обратимым, если возвращение этой системы в исходное состояние (из 2 в 1) может быть осуществлено через те же промежуточные состояния и при этом (после возвращения системы в исходное состояние) в окружающей среде не останется никаких изменений.
Если же такое возвращение невозможно, то данный прямой процесс является необратимым.
Рассмотрим следующий пример.

|
| Рис. 3.1 |
1. В цилиндре под невесомым поршнем, нагруженным сверху гирей массы М, находится газ (рис. 3.1). Над поршнем - вакуум. Трение и протечка газа между цилиндром и поршнем отсутствуют. Очевидно, давление газа равно  , где g - ускорение земного тяготения, а
, где g - ускорение земного тяготения, а
F - площадь поршня.
Рассмотрим теперь процесс равновесного расширения этого газа в результате подвода к нему через стенки цилиндра теплоты Q. Газ, расширяясь при постоянном давлении, поднимет поршень с гирей из положения 1 в положение 2 на высоту h и произведет при этом работу против силы тяжести  .
.
Для возвращения системы в исходное состояние отнимем (в равновесном процессе) от газа то же самое количество теплоты. Поршень опустится на ту же самую величину h и при этом сила тяжести произведет над газом такую же работу  .
.
Таким образом, при возвращении системы в исходное состояние во внешней среде не произойдет никаких изменений, так как работа и теплота в прямом и в обратном процессах одинаковы по величине и противоположны по знаку. Следовательно, данный процесс расширения газа является обратимым.
Обязательным условием обратимости этого процесса (как и любого другого) является его равновесность, так как иначе, например, давление газа на поршень не равнялось бы среднему давлению газа в цилиндре, что привело бы к потере части работы, и т.д.
2. Рассмотрим такой же процесс расширение газа в том же цилиндре, но при наличии трения поршня о стенки цилиндра. Пусть давление газа р при его расширении и перемещение поршня на высоту h такие же, как и в предыдущем случае. Но из-за наличия трения масса гири М¢, которая может быть поднята поршнем, будет меньше М. Работа, совершенная газом против силы тяжести, будет равна 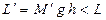 (т.е. меньше, чем при отсутствии трения). А чтобы вернуть поршень в исходное положение при том же давлении газа придется приложить к поршню с гирей (массой М¢) дополнительную силу, т.е. совершить дополнительную работу, что приведет к изменению состояния внешней среды. Следовательно, процесс 1 - 2 в этом случае является необратимым.
(т.е. меньше, чем при отсутствии трения). А чтобы вернуть поршень в исходное положение при том же давлении газа придется приложить к поршню с гирей (массой М¢) дополнительную силу, т.е. совершить дополнительную работу, что приведет к изменению состояния внешней среды. Следовательно, процесс 1 - 2 в этом случае является необратимым.
Из приведенного примера видна характерная особенность необратимого процесса, заключающаяся в том, что работа против внешних сил в таком процессе при прочих равных условиях меньше той, которую можно было бы получить при его обратимом протекании.
В данном случае потеря работы связана с тем, что при движения поршня часть механической работы переходит (в результате трения) в теплоту, т.е. в энергию хаотического движения микрочастиц. Такие процессы называются диссипативными. Их наличие всегда приводит к необратимости термодинамического процесса, в котором они наблюдаются.

|
| Рис. 3.2 |
3. Рассмотрим еще один пример - расширение газа в пустоту. Пусть в системе (рис. 3.2) имеются две полости 1 и 2, соединенные каналом, перекрытым краном 3. В левой полости находится газ с давлением p1. Правый сосуд пуст (вакуумирован). Если открыть кран, то газ, расширяясь, будет перетекать в правый сосуд. После установления равновесия давление газа станет одинаковым в обоих сосудах и равным 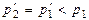 . При этом газ, расширяясь, в данном случае не совершит никакой полезной работы. Однако, для возвращения системы в исходное состояние, т. е. длявозвращения всего газа в левый сосуд, потребуется работа сжатия, подведенная извне. Следовательно, данный процесс является необратимым.
. При этом газ, расширяясь, в данном случае не совершит никакой полезной работы. Однако, для возвращения системы в исходное состояние, т. е. длявозвращения всего газа в левый сосуд, потребуется работа сжатия, подведенная извне. Следовательно, данный процесс является необратимым.
4. Еще одним типичным примером необратимого процесса является процесс передачи теплоты от тела с более высокой температурой к телу с меньшей температурой. Как известно, если передача теплоты от горячего тела к холодному при их контакте проходит самопроизвольно, то обратный процесс (например, охлаждение продуктов в холодильнике) возможен лишь при затрате энергии извне, т. е. при изменении состояния внешней среды.
Подчеркнем, что любой самопроизвольный процесс является необратимым. Действительно, самопроизвольный процесс протекает до тех пор, пока в системе не установится равновесие. Система же, достигшая равновесного состояния, не способна к самопроизвольному выходу из этого состояния. Иначе говоря, обратный процесс по отношению к данному самопроизвольному может быть осуществлен лишь путем подвода энергии извне, т.е. с изменением состояния внешней среды.
Заметим при этом, что самопроизвольные процессы являются неравновесными, т.к. самопроизвольное протекание какого-либо процесса возможно лишь при отсутствии равновесия в системе.
Все процессы, протекающие в природе или в технических устройствах, в той или иной мере являются необратимыми из-за конечной скорости их протекания (ведущей к неравновесности) и (или) из-за наличия диссипативных эффектов, например, трения.
Круговые процессы (циклы)




