Равновесным называется процесс, при осуществлении которого система
проходит через непрерывный ряд равновесных состояний. Следовательно, при протекании равновесного процесса в каждый данный момент давление и температура во всех частях системы одинаковы.
Неравновесным называется процесс, при протекании которого система не находится в состоянии равновесия. При осуществлении такого процесса давление и температура в различных областях системы могут быть неодинаковы.
Реальные процессы, протекающие в технических устройствах, в принципе являются неравновесными. Это объясняется тем, что изменение состояния системы, представляющее собой термодинамический процесс, может быть осуществлено только посредством внешнего воздействия путем нарушения равновесия. Однако можно представить такие условия протекания реальных процессов, когда они становятся практически равновесными(квазиравновесными, т.е. как бы равновесными). Очевидно, что для этого нарушения равновесия в системе должны быть бесконечно малыми; последнее может быть достигнуто медленным изменением состояния систем, т. е. медленным протеканием процесса.
Рассмотрим для примера сжатие газа в цилиндре с помощью поршня. При движении поршня в первую очередь будут сжиматься слои газа, которые непосредственно прилегают к поверхности поршня. Следовательно, давление в этих слоях газа будут выше среднего давления газа в цилиндре. Поэтому в процессе сжатия давление газа в цилиндре является неодинаковым и сам процесс неравновесным. Передача этого, вызванного перемещением поршня, изменения давления происходит с конечной скоростью, равной скорости звука. Если скорость перемещения поршня wn мала по сравнению со скоростью звука а, то давление в каждый данный момент будет успевать выравниваться по всему объему цилиндра и процесс будет квазиравновесным. Наоборот, при соизмеримых значениях wn и а процесс будет неравновесным. Таким образом, равновесный процесс является предельным случаем неравновесного при стремлении скорости последнего к нулю. Замена реального процесса равновесным позволяет для его исследования использовать термодинамические уравнения и методы анализа, что дает весьма плодотворные результаты и часто очень точные.
1.5. Теплоемкость и факторы на неё влияющие
Виды теплоемкости
Теплоемкость – это количество теплоты, поглощаемой телом (газом), при повышении его температуры на один градус Цельсия.
Удельная теплоемкость – это теплоемкость 1 кг вещества. Она обозначается символом «с» и имеет размерность Дж/(кг∙К).
Мольная теплоемкость – это теплоемкость 1 моля вещества
(с μ, Дж/(моль∙К).
Истинная теплоемкость 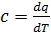 (1.4)
(1.4)
– это бесконечно малое количество теплоты  , необходимое для нагрева 1 кг вещества на бесконечно малую величину
, необходимое для нагрева 1 кг вещества на бесконечно малую величину 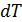 .
.
Средняя теплоемкость газа в интервале температур от Т 1 до Т 2
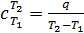 (1.5)
(1.5)
– это количество теплоты, подведенное к 1 кг вещества при изменении его температуры от Т 1 до Т 2.
Теплоемкость газов
Теплоемкость газов зависит от:
‒ типа термодинамического процесса (изохорный, изобарный, изотермический и др.);
‒ рода газа, т.е. от числа атомов в молекуле;
‒ параметров состояния газа (давления, температуры и др.).






