Задание 37
1.Составьте методику количественного определения Na2СО3 в твердом
образце методом прямого кислотно-основного титрования, для чего
последовательно ответьте на следующие вопросы и проведите
соответствующие расчеты.
1.1. Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный).
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3. Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4. Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5. Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6. Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7. Схематически зарисуйте этапы работы.
2.Решите задачу.
Задание 38
1. Составьте методику количественного определения H2C4H4O6 в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1 Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3 Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,1 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6 Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2.Решите задачу.
Задание 39
1. Составьте методику количественного определения NaОН в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1. Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2 Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3 Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6 Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2.Решите задачу.
Задание 40
1. Составьте методику количественного определения Na2B4О7 × H2O в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1 Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3. Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4. Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6 Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2.Решите задачу.
Задание 41
1. Составьте методику количественного определения Н2С2О4 × 2Н2О в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1. Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2.Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3.Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6 Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2.Решите задачу.
Задание 42.
1. Составьте методику количественного определения Н2С4Н4О4 в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1. Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3. Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4. Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5. Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6. Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7. Схематически зарисуйте этапы работы.
2. Решите задачу.
Задание 43
1. Составьте методику количественного определения К2СО3 в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1. Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3. Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,1 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4. Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5. Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6. Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7. Схематически зарисуйте этапы работы.
2. Решите задачу.
Задание 44
1.Составьте методику количественного определения С6Н5СООН в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1 Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2 Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3 Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6.Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2. Решите задачу.
Задание 45
1. Составьте методику количественного определения NaНСО3 в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1 Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2 Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3 Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6 Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2. Решите задачу.
Задание 47
1. Составьте методику количественного определения Н2С4Н4О4 в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1 Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3 Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,1 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6. Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2. Решите задачу.
Задание 48
1. Составьте методику количественного определения КНСО3 в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1 Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3. Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,1 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6 Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2.Решите задачу.
Задание 49
1.Составьте методику количественного определения Н2С2О4 × 2Н2О в твердом образце методом прямого кислотно-основного титрования, для чего последовательно ответьте на следующие вопросы и проведите соответствующие расчеты.
1.1. Запишите уравнение реакции между анализируемым веществом и титрантом, и обоснуйте способ титрования (прямой, обратный, заместительный)
1.2. Рассчитайте молярную массу эквивалента анализируемого соединения.
1.3 Рассчитайте массу навески твердого образца, необходимую для определения методом пипетирования (концентрация титранта 0,05 моль/дм3). Какой концентрации будете готовить раствор анализируемого соединения?
1.4 Рассчитайте рН в точке эквивалентности и подберете индикатор для фиксирования этой точки.
1.5 Составьте методику титрования, где укажите объем аликвотной части анализируемого раствора, количество капель индикатора, до какого изменения цвета будете титровать?
1.6 Напишите формулу расчета массовой доли в процентах определяемого соединения в исследуемом образце.
1.7 Схематически зарисуйте этапы работы.
2.Решите задачу.
Тема 5: Перманганатометрия
Задание 49
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 3 дм3 раствора с С(1/5 KMnO4)=0,1 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Na2C4O4.
1.5.1. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Na2C4O4.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0036 г.
1.5.4. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 19,92 см3 KMnO4?
2. Обоснуйте методику определения массовой доли железа (II) (NH4)2Fe(SO4)2.6H2O методом перменганатометрии.
2.1. Напишите уравнение титриметрической реакции отметьте способ титрования, рассчитайте Мэ(Fe2+) и Мэ соли (NH4)2Fe(SO4)2.6H2O.
2.2. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца. В какой измерительной посуде необходимо готовить его раствор?
2.3. При составлении методики учтите гидролиз анализируемой соли железа (II). Как подавить этот процесс?
2.4. Рассчитайте массовую долю Fe (II) в анализируемом образце, если масса практической навески меньше теоретической на 0,0042., W=200,00 см3,  в=14,12 см3, Vал= 15,00 см3.
в=14,12 см3, Vал= 15,00 см3.
2.5. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 50
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 5 дм3 раствора с С(1/5 KMnO4)=0,05 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Н2C4O4 . 2Н2О.
1.5.1. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Н2C4O4 . 2Н2О.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0028 г.
1.5.4. Приготовьте также раствор ПСВ из фиксанала, содержащего 0,1 Мэ ПСВ. Какая измерительная посуда и какой вместимостью необходима вам для этого?
1.5.5. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 20,16 см3 KMnO4?
1.6. Схематически зарисуйте этапы работы.
2. Обоснуйте методику перманганатометрического определения пероксида водорода в растворе, имеющем плотность 1,094 г/см3 (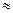 26%).
26%).
2.1. Напишите уравнение титриметрической реакции, рассчитайте Мэ (Н2О2).
2.2. Определите, следует ли развести анализируемый жидкий образец.
2.2.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.2.2. Рассчитайте объем или массу навески жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации и какого объема). Как правильнее взять для разведения данный жидкий образец: по массе или по объему? На каких весах вы обязаны определить массу навески жидкого образца, как количественно перенести ее в мерную колбу?
2.3. Напишите формулу расчета массовой доли пероксида водорода в жидком образце.
2.4. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если масса практической навески жидкого образца больше теоретической на 0,0025., а на титрование 15,00 см3 разбавленного анализируемого раствора затрачивается 15,45 см3 титрованного раствора KMnO4.
2.5. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 51
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2 Рассчитайте массу навески кристаллического KMnO4 для приготовления 1 дм3 раствора с С(1/5 KMnO4)=0,1 моль/дм3.
1.3 Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4 Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Na2C4O4.
1.5.1. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Na2C2O4.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0016 г.
1.5.4. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 19,98 см3 KMnO4?
2. Обоснуйте методику определения массовой доли Н2С2О4 в
Н2С2О4 × 2Н2О методом перменганатометрии.
2.1. Напишите уравнение титриметрической реакции отметьте способ титрования, рассчитайте Мэ(Н2С2О4) и Мэ Н2С2О4 × 2Н2О
2.2. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца. В какой измерительной посуде необходимо готовить его раствор?
2.3. Рассчитайте массовую долю Н2С2О4 в анализируемом образце, если масса практической навески меньше теоретической на 0,0040., W=200,00 см3,  в=14,11 см3, Vал= 15,00 см3.
в=14,11 см3, Vал= 15,00 см3.
2.4. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 52
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 5 дм3 раствора с С(1/5 KMnO4)=0,05 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Н2C4O4 . 2Н2О.
1.5.1. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Н2C4O4 . 2Н2О.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0020 г.
1.5.4. Приготовьте также раствор ПСВ из фиксанала, содержащего 0,1 Мэ ПСВ. Какая измерительная посуда и какой вместимостью необходима вам для этого?
1.5.5. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 20,10 см3 KMnO4?
1.6. Схематически зарисуйте этапы работы.
2. Обоснуйте методику перманганатометрического определения пероксида водорода в растворе, имеющем плотность 1,02 г/см3 (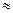 6%).
6%).
2.1. Напишите уравнение титриметрической реакции, рассчитайте Мэ(Н2О2).
2.2. Определите, следует ли развести анализируемый жидкий образец.
2.2.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.2.2 Рассчитайте объем или массу навески жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации и какого объема). Как правильнее взять для разведения данный жидкий образец: по массе или по объему? На каких весах вы обязаны определить массу навески жидкого образца, как количественно перенести ее в мерную колбу?
2.3. Напишите формулу расчета массовой доли пероксида водорода в жидком образце.
2.4. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если масса практической навески жидкого образца меньше теоретической на 0,1345, а на титрование 15,00 см3 разбавленного анализируемого раствора затрачивается 15,12 см3 титрованного раствора KMnO4.
2.5. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 53
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 3 дм3 раствора с С(1/5 KMnO4)=0,1 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Na2C2O4.
1.5.1. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Na2C2O4.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0026 г.
1.5.4. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 19,98 см3 KMnO4?
2. Обоснуйте методику определения массовой доли железа (II)
FeSO4 . 7H2O методом перменганатометрии.
2.1. Напишите уравнение титриметрической реакции отметьте способ титрования, рассчитайте Мэ(Fe2+) и Мэ соли FeSO4 . 7H2O).
2.2. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца. В какой измерительной посуде необходимо готовить его раствор?
2.3. При составлении методики учтите гидролиз анализируемой соли железа (II). Как подавить этот процесс?
2.4. Рассчитайте массовую долю Fe (II) в анализируемом образце, если масса практической навески меньше теоретической на 0,0041, W=100,00 см3,  в=10,12 см3, Vал= 10,00 см3.
в=10,12 см3, Vал= 10,00 см3.
2.5. Схематически зарисуйте этапы работы.
Задание 54
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 5 дм3 раствора с С(1/5 KMnO4)=0,05 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Н2C4O4 . 2Н2О.
1.5.1. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Н2C4O4 . 2Н2О.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0028 г.
1.5.4. Приготовьте также раствор ПСВ из фиксанала, содержащего 0,1 Мэ ПСВ. Какая измерительная посуда и какой вместимостью необходима вам для этого?
1.5.5.Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 20,16 см3 KMnO4?
1.6. Схематически зарисуйте этапы работы.
2. Обоснуйте методику перманганатометрического определения пероксида водорода в растворе, имеющем плотность 1,042 г/см3 (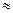 12%).
12%).
2.1. Напишите уравнение титриметрической реакции, рассчитайте Мэ(Н2О2).
2.2. Определите, следует ли развести анализируемый жидкий образец.
2.2.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.2.2.Рассчитайте объем или массу навески жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации и какого объема). Как правильнее взять для разведения данный жидкий образец: по массе или по объему? На каких весах вы обязаны определить массу навески жидкого образца, как количественно перенести ее в мерную колбу?
2.3.Напишите формулу расчета массовой доли пероксида водорода в жидком образце.
2.4. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если масса практической навески жидкого образца больше теоретической на 0,0015, а на титрование 10,00 см3 разбавленного анализируемого раствора затрачивается 10,45 см3 титрованного раствора KMnO4.
2.5. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 55
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 3 дм3 раствора с С(1/5 KMnO4)=0,1 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Na2C2O4.
1.5.1.Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Na2C2O4.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0003 г.
1.5.4. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 19,91 см3 KMnO4?
2. Обоснуйте методику определения массовой доли Na2SO3 в
Na2SO3 ×7Н2О методом перменганатометрии.
2.1. Напишите уравнение титриметрической реакции отметьте способ титрования, рассчитайте Мэ Na2SO3 и Мэ соли Na2SO3 ×7Н2О.
2.2. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца. В какой измерительной посуде необходимо готовить его раствор?
2.3. Рассчитайте массовую долю Na2SO3 в анализируемом образце, если масса практической навески больше теоретической на 0,0245, W=200,00 см3, объем раствора из бюретки = 16,32 см3, VB = 15,00 см3.
2.4. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 56
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 5 дм3 раствора с С(1/5 KMnO4)=0,05 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Н2C4O4 . 2Н2О.
1.5.2. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Н2C4O4 . 2Н2О.
1.5.3. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.4. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0018 г.
1.5.5. Приготовьте также раствор ПСВ из фиксанала, содержащего 0,1 Мэ ПСВ. Какая измерительная посуда и какой вместимостью необходима вам для этого?
1.5.6. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 20,18 см3 KMnO4?
1.6. Схематически зарисуйте этапы работы.
2. Обоснуйте методику перманганатометрического определения пероксида водорода в растворе, имеющем плотность 1,035 г/см3 (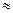 10%).
10%).
2.8. Напишите уравнение титриметрической реакции, рассчитайте Мэ(Н2О2).
2.9. Определите, следует ли развести анализируемый жидкий образец.
2.9.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.9.2. Рассчитайте объем или массу навески жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации и какого объема). Как правильнее взять для разведения данный жидкий образец: по массе или по объему? На каких весах вы обязаны определить массу навески жидкого образца, как количественно перенести ее в мерную колбу?
2.10. Напишите формулу расчета массовой доли пероксида водорода в жидком образце.
2.11. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если масса практической навески жидкого образца больше теоретической на 0,0025., а на титрование 15,00 см3 разбавленного анализируемого раствора затрачивается 15,45 см3 титрованного раствора KMnO4.
2.12. Схематически зарисуйте этапы работы.
Задание 57
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 3 дм3 раствора с С(1/5 KMnO4)=0,1 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Na2C4O4.
1.5.1. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Na2C4O4.
1.5.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0006 г.
1.5.4. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 19,98 см3 KMnO4?
2. Обоснуйте методику определения массовой доли NaNO2 в твердом образце методом перменганатометрии.
2.1. Напишите уравнение титриметрической реакции отметьте способ титрования, рассчитайте Мэ NaNO2.
2.2. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца. В какой измерительной посуде необходимо готовить его раствор?
2.3. Рассчитайте массовую долю NaNO2 в анализируемом образце, если масса практической навески меньше теоретической на 0,0022, W=100,00 см3, объем раствора из бюретки = 22,17 см3,
VB = 20,00 см3.
2.4. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 58
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 5 дм3 раствора с С(1/5 KMnO4)=0,05 моль/дм3.
Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.3. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.4. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Н2C2O4 . 2Н2О.
1.5. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Н2C2O4 . 2Н2О.
1.5.1. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.5.2. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0028 г.
1.5.3. Приготовьте также раствор ПСВ из фиксанала, содержащего 0,1 Мэ ПСВ. Какая измерительная посуда и какой вместимостью необходима вам для этого?
1.5.4. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 20,16 см3 KMnO4?
1.6. Схематически зарисуйте этапы работы.
2. Обоснуйте методику перманганатометрического определения пероксида водорода в растворе, имеющем плотность 1,073 г/см3 (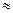 20%).
20%).
2.1. Напишите уравнение титриметрической реакции, рассчитайте Мэ(Н2О2).
2.2. Определите, следует ли развести анализируемый жидкий образец.
2.2.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.2.2. Рассчитайте объем или массу навески жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации и какого объема). Как правильнее взять для разведения данный жидкий образец: по массе или по объему? На каких весах вы обязаны определить массу навески жидкого образца, как количественно перенести ее в мерную колбу?
2.3. Напишите формулу расчета массовой доли пероксида водорода в жидком образце.
2.4. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если масса практической навески жидкого образца больше теоретической на 0,0025., а на титрование 15,00 см3 разбавленного анализируемого раствора затрачивается 15,45 см3 титрованного раствора KMnO4.
2.5. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 59
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 3 дм3 раствора с С(1/5 KMnO4)=0,1 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.5. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Na2C2O4.
1.6.1 Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Na2C2O4. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.6.1 Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0018 г.
1.6.1 Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 19,92 см3 KMnO4?
2. Обоснуйте методику определения массовой доли NaAsO2 в твердом образце методом перменганатометрии.
2.1. Напишите уравнение титриметрической реакции отметьте способ титрования, рассчитайте Мэ NaAsO2 .
2.2. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца. В какой измерительной посуде необходимо готовить его раствор?
2.3. Рассчитайте массовую долю NaAsO2 в анализируемом образце, если масса практической навески меньше теоретической на 0,0038, W=200,00 см3,  в=24,12 см3, Vал= 25,00 см3.
в=24,12 см3, Vал= 25,00 см3.
2.4. Схематически зарисуйте этапы работы.
3. Решите задачу.
Задание 60
1.Обоснуйте методику приготовления титрованного раствора перманганата калия. Для решения поставленной задачи выполните следующие задания:
1.1. Ответьте, первичным или вторичным стандартным веществом является KMnO4?
1.2. Рассчитайте массу навески кристаллического KMnO4 для приготовления 5 дм3 раствора с С(1/5 KMnO4)=0,05 моль/дм3.
1.3. Перечислите условия приготовления титранта. Какие весы и измерительную посуду вы будете использовать при этом?
1.4. Перечислите первичные стандартные вещества (ПСВ) для стандартизации приготовленного раствора KMnO4.
1.4.1. Проведите стандартизацию приготовленного раствора KMnO4 по х.ч. Н2C2O4 . 2Н2О. Напишите уравнение реакции, лежащей в основе стандартизации. Рассчитайте Мэ Н2C2O4 . 2Н2О.
1.4.2. Рассчитайте массу навески ПСВ для титрования аликвотной части его раствора. Подумайте, какой концентрации необходимо приготовить раствор ПСВ, на каких весах следует измерить массу навески ПСВ, в какой измерительной посуде необходимо готовить ПСВ.
1.4.3. Рассчитайте Сн раствора ПСВ, если масса практической навески больше теоретически рассчитанной на 0,0008 г.
1.4.4. Приготовьте также раствор ПСВ из фиксанала, содержащего 0,1 Мэ ПСВ. Какая измерительная посуда и какой вместимостью необходима вам для этого?
1.4.5. Рассчитайте эквивалентную концентрацию и поправочный коэффициент раствора KMnO4, если на титрование 20,00 см3 ПСР израсходовано в среднем 20,06 см3 KMnO4?
1.6. Схематически зарисуйте этапы работы.
2. Обоснуйте методику перманганатометрического определения пероксида водорода в растворе, имеющем плотность 1,028 г/см3 (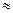 8%).
8%).
2.1. Напишите уравнение титриметрической реакции, рассчитайте Мэ(Н2О2).
2.2. Определите, следует ли развести анализируемый жидкий образец.
2.2.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.2.2. Рассчитайте объем или массу навески жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации и какого объема). Как правильнее взять для разведения данный жидкий образец: по массе или по объему? На каких весах вы обязаны определить массу навески жидкого образца, как количественно перенести ее в мерную колбу?
2.3. Напишите формулу расчета массовой доли пероксида водорода в жидком образце.
2.4. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если масса практической навески жидкого образца больше теоретической на 0,0025., а на титрование 15,00 см3 разбавленного анализируемого раствора затрачивается 15,45 см3 титрованного раствора KMnO4.
2.5. Схематически зарисуйте этапы работы.
3. Решите задачу.
Тема 6: Йодометрия.
Задание 61
1. В лаборатории необходимо приготовить 3 дм3 раствора тиосульфата натрия с Сэ=0,1 моль/дм3. Для решения задачи:
1.1. Укажите, первичным или вторичным стандартным веществом является тиосульфат натрия?
1.2. Напишите уравнение полуреакции окисления тиосульфат-иона для обоснования расчета Мэ тиосульфата натрия.
1.3. Рассчитайте массу навески тиосульфата натрия пентагидрата для приготовления его стандартного раствора.
1.4. Укажите, какую измерительную посуду и весы вы будете использовать для приготовления стандартного раствора тиосульфата натрия. Перечислите особенности приготовления и хранения этого раствора.
1.5. Перечислите первичные стандартные вещества (ПСВ), которые можно использовать для стандартизации приготовленного раствора тиосульфата натрия.
1.6. Проведите стандартизацию приготовленного раствора тиосульфата натрия по х.ч. К2Cr2O7.
1.6.1. Напишите уравнение реакции, лежащей в основе стандартизации.
1.6.2. Обоснуйте расчет Мэ ПСВ.
1.6.3. Рассчитайте массу навески ПСВ, используя прием титрования отдельной навески ПСВ. В лаборатории имеется бюретка на 50,00 см3.
1.6.4. Укажите, на каких весах вы будете измерять массу навески ПСВ.
1.6.5. Рассчитайте Снпр и поправочный коэффициент приготовленного раствора тиосульфата натрия, если на титрование трех отдельных навесок с массой меньше теоретически рассчитанной на 0,0012 г, 0,0014 г, 0,0016 г израсходовано раствора тиосульфата натрия меньше, чем рассчитанный объем на 0,08 см3, 0,12 см3, 0,16 см3 соответственно.
1.7. Схематически зарисуйте этапы работы.
2. Обоснуйте методику йодометрического определения пероксида водорода в жидком образце с плотностью 1,013 г/см3 (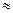 4%).
4%).
2.1. Напишите уравнение титриметрической реакции, лежащей в основе определения Н2О2 (окислителя), рассчитайте Мэ(Н2О2).
2.2. Определите, следует ли развести анализируемый жидкий образец.
2.2.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.2.2. Рассчитайте, во сколько раз необходимо разбавить анализируемый раствор.
2.2.3. Рассчитайте объем жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации). Какой мерной посудой следует пользоваться при разведении по жидкого образца объему?
2.3. Напишите формулу расчета массовой доли пероксида водорода при разведении жидкого образца по объему.
2.4. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если при титровании 15,00 см3 разбавленного анализируемого раствора затрачивается 15,25 см3 титрованного раствора тиосульфата натрия (Сн[Na2S2O3] из п. 1.6.5.) Объем мерной колбы и пипетки Мора, использованной при разбавлении жидкого образца, рассчитан вами самостоятельно.
2.5. Схематически зарисуйте этапы работы.
3. Составьте методику количественного определения Na2SO3 в твердом образце.
3.1. Напишите уравнение титриметрической реакции.
3.2. Укажите способ титрования.
3.3. Приведите формулы расчета навески и массовой доли определяемого вещества в образце.
4. Решите задачу.
Задание 62.
1. В лаборатории необходимо приготовить 5 дм3 раствора тиосульфата натрия с Сэ=0,1 моль/дм3. Для решения задачи:
1.1. Укажите, первичным или вторичным стандартным веществом является тиосульфат натрия?
1.2. Напишите уравнение полуреакции окисления тиосульфат-иона для обоснования расчета Мэ тиосульфата натрия.
1.3. Рассчитайте массу навески тиосульфата натрия пентагидрата для приготовления его стандартного раствора.
1.4. Укажите, какую измерительную посуду и весы вы будете использовать для приготовления стандартного раствора тиосульфата натрия. Перечислите особенности приготовления и хранения этого раствора.
1.5. Перечислите первичные стандартные вещества (ПСВ), которые можно использовать для стандартизации приготовленного раствора тиосульфата натрия.
1.6. Проведите стандартизацию приготовленного раствора тиосульфата натрия по х.ч. йоду кристаллическому.
1.6.1. Напишите уравнение реакции, лежащей в основе стандартизации.
1.6.2. Обоснуйте расчет Мэ ПСВ.
1.6.3. Рассчитайте массу навески ПСВ, используя прием титрования аликвоты первичного стандартного раствора (ПСР). В лаборатории имеется мерные колбы на 100,00 см3, 200,00 см3.
1.6.4. Укажите, на каких весах вы будете измерять массу навески ПСВ.
1.6.5. Напишите формулу для расчета Снпр ПСР.
1.6.6. Рассчитайте Снпр и поправочный коэффициент приготовленного раствора натрия тиосульфата, если на титрование 20, 00 см3 ПСР с К=0,9982 израсходовано 19,82 см3 ВСР.
1.7. Схематически зарисуйте этапы работы.
2. Обоснуйте методику йодиметрического определения в твердом образце.
2.1. Напишите уравнение реакций, лежащих в основе определения K2Cr2O7 (окислителя), рассчитайте Мэ K2Cr2O7.
2.2. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца? В какой измерительной посуде необходимо готовить его раствор?
2.3. Напишите формулу расчета массовой доли K2Cr2O7 в твердом образце при использовании приема пипетирования.
2.4. Рассчитайте массовую долю K2Cr2O7 в анализируемом образце, если масса практической навески больше теоретической на 0,0155 г., на титрование 15,00 см3 анализируемого раствора в среднем затрачивается  в=14,65 см3 тиосульфата натрия (Сн Na2S2O3 возьмите из п. 1.6.6.).
в=14,65 см3 тиосульфата натрия (Сн Na2S2O3 возьмите из п. 1.6.6.).
2.5. Схематически зарисуйте этапы работы.
3. Составьте методику количественного определения As2O3 в твердом образце.
3.1. Напишите уравнение титриметрической реакции.
3.2. Укажите способ титрования.
3.3. Приведите формулы расчета навески и массовой доли определяемого вещества в образце.
4. Решите задачу.
Задание 63
1. В лаборатории необходимо приготовить 2 дм3 раствора тиосульфата натрия с Сэ=0,1 моль/дм3. Для решения задачи:
1.1. Укажите, первичным или вторичным стандартным веществом является тиосульфат натрия?
1.2. Напишите уравнение полуреакции окисления тиосульфат-иона для обоснования расчета Мэ тиосульфата натрия.
1.3. Рассчитайте массу навески тиосульфата натрия пентагидрата для приготовления его стандартного раствора.
1.4. Укажите, какую измерительную посуду и весы вы будете использовать для приготовления стандартного раствора тиосульфата натрия. Перечислите особенности приготовления и хранения этого раствора.
1.5. Перечислите первичные стандартные вещества (ПСВ), которые можно использовать для стандартизации приготовленного раствора тиосульфата натрия.
1.6. Проведите стандартизацию приготовленного раствора тиосульфата натрия по х.ч. КBrO3.
1.6.1. Напишите уравнение реакции, лежащей в основе стандартизации.
1.6.2. Обоснуйте расчет Мэ ПСВ.
1.6.3. Рассчитайте массу навески ПСВ, используя прием титрования аликвоты первичного стандартного раствора (ПСР). В лаборатории имеется мерные колбы на 100,00 см3, 200,00 см3.
1.6.4. Укажите, на каких весах вы будете измерять массу навески ПСВ.
1.6.5. Напишите формулу для расчета Снпр ПСР.
1.6.6. Рассчитайте Снпр и поправочный коэффициент приготовленного раствора натрия тиосульфата, если на титрование 20, 00 см3 ПСР с К=0,9980 израсходовано 19,80 см3 ВСР.
1.7. Схематически зарисуйте этапы работы.
2. Обоснуйте методику йодометрического определения пероксида водорода в жидком образце с плотностью 1,006 г/см3 (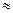 2%).
2%).
2.1. Напишите уравнение титриметрической реакции, лежащей в основе определения Н2О2 (окислителя), рассчитайте Мэ (Н2О2).
2.2. Определите, следует ли развести анализируемый жидкий образец.
2.2.1. Рассчитайте эквивалентную концентрацию анализируемого раствора Н2О2.
2.2.2. Рассчитайте, во сколько раз необходимо разбавить анализируемый раствор.
2.2.3. Рассчитайте объем жидкого образца, который необходимо взять для приготовления разбавленного раствора (подумайте какой концентрации). Какой мерной посудой следует пользоваться при разведении по жидкого образца объему?
2.3. Напишите формулу расчета массовой доли пероксида водорода при разведении жидкого образца по объему.
2.4. Рассчитайте массовую долю пероксида водорода в анализируемом растворе, если при титровании 15,00 см3 разбавленного анализируемого раствора затрачивается 15,24 см3 титрованного раствора тиосульфата натрия (Сн[Na2S2O3] из п. 1.6.5.) Объем мерной колбы и пипетки Мора, использованной при разбавлении жидкого образца, рассчитан вами самостоятельно.
2.5. Схематически зарисуйте этапы работы.
3. Составьте методику количественного определения NaAsO2 в твердом образце.
3.1. Напишите уравнение титриметрической реакции.
3.2. Укажите способ титрования.
3.3. Приведите формулы расчета навески и массовой доли определяемого вещества в образце.
4. Решите задачу.
Задание 64
1. В лаборатории необходимо приготовить 2 дм3 раствора йода с Сэ=0,1 моль/дм3. Для решения задачи:
1.1. Укажите, первичным или вторичным стандартным веществом является йод?
1.2. Напишите уравнение полуреакции восстановления йода для обоснования расчета Мэ йода.
1.3. Рассчитайте массу навески йода для приготовления его стандартного раствора.
1.4. Укажите, какую измерительную посуду и весы вы будете использовать для приготовления стандартного раствора тиосульфата натрия. Перечислите особенности приготовления и хранения этого раствора.
1.5. Перечислите первичные стандартные вещества (ПСВ), которые можно использовать для стандартизации приготовленного раствора йода.
1.6. Проведите стандартизацию приготовленного раствора тиосульфата натрия по х.ч. As2O3.
1.6.1. Напишите уравнение реакции, лежащей в основе стандартизации.
1.6.2. Обоснуйте расчет Мэ ПСВ.
1.6.3. Рассчитайте массу навески ПСВ, используя прием титрования аликвоты первичного стандартного раствора (ПСР). В лаборатории имеется мерные колбы на 100,00 см3, 200,00 см3.
1.6.4. Укажите, на каких весах вы будете измерять массу навески ПСВ.
1.6.5. Напишите формулу для расчета Снпр ПСР.
1.6.6. Рассчитайте Снпр и поправочный коэффициент приготовленного раствора натрия тиосульфата, если на титрование 15, 00 см3 ПСР с К=0,9992 израсходовано 14,82 см3 ВСР.
1.7. Схематически зарисуйте этапы работы.
2. Обоснуйте методику йодиметрического определения Na2S в твердом образце.
2.1. Напишите уравнение реакций, лежащих в основе определения Na2S, рассчитайте Мэ Na2S.
2.1. Рассчитайте массу навески анализируемого образца, используя титрование по приему пипетирования. На каких весах следует определить массу навески анализируемого образца? В какой измерительной посуде необходимо готовить его раствор?
2.2. Напишите формулу расчета массовой доли Na2S в твердом образце при использовании приема пипетирования.
2.3. Рассчитайте массовую долю Na2S в анализируемом образце, если масса практической навески больше теоретической на 0,0155 г., на титрование 15,00 см3 анализируемого раствора в среднем затрачивается  в=14,65 см3 йода (Сн йода возьмите из п. 1.6.6.).
в=14,65 см3 йода (Сн йода возьмите из п. 1.6.6.).
2.4. Схематически зарисуйте этапы работы.
3. Составьте методику количественного определения Н2О2 в жидком образце.
3.1. Напишите уравнение титриметрической реакции.
3.2. Укажите способ титрования.
3.3. Приведите формулы расчета объема исходного раствора и массовой доли определяемого вещества в образце.
4. Решите задачу.
Задание 65
1. В лаборатории необходимо приготовить 2 дм3 раствора тиосульфата натрия с Сэ=0,1 моль/дм3. Для решения задачи:
Укажите, первичным или вторичным стандартным веществом является тиосульфат натрия?
Напишите уравнение полуреакции окисления тиосульфат-иона для обоснования расчета Мэ тиосульфата натрия.
Рассчитайте массу навески тиосульфата натрия пентагидрата для приготовления его стандартного раствора.
Укажите, какую измерительную посуду и весы вы будете использовать для приготовления стандартного раствора тиосульфата натрия. Перечислите особенности приготовления и хранения этого раствора.
Перечислите первичные стандартные вещества (ПСВ), которые можно использовать для стандартизации приготовленного раствора тиосульфата натрия.
Проведите стандартизацию приготовленного раствора тиосульфата натрия по х.ч. К2Сr2O7.
Напишите уравнение реакции, лежащей в основе стандартизации.
Обоснуйте расчет Мэ ПСВ.
Рассчитайте массу навески ПСВ, используя прием титрования аликвоты первичного стандартного раствора (ПСР). В лаборатории имеется мерные колбы на 100,00 см3, 200,00 см3.
Укажите, на каких весах вы будете измерять массу навески ПСВ.
Напишите формулу для расчета Снпр ПСР.
Рассчитайте Снпр и поправочный коэффициент приготовленного раствора натрия тиосульфата, если на титрование 20, 00 см Дата добавления: 2016-10-23; Мы поможем в написании ваших работ!; просмотров: 483 | Нарушение авторских прав Лучшие изречения:






