Аналитическая химия
Сборник заданий
По количественному химическому анализу
для самостоятельной внеаудиторной работы студентов
2 курса фармацевтического факультета
Хабаровск 2012
УДК 543 (076.5)
ББК 24.4 я 73
К 604
Составители:
1. Доцент Н.В. Ленчик
Рецензенты:
Зав. кафедрой химии Н.Н.Минаева, доцент кафедры фармацевтической и аналитической химии В.И. Сигова.
Утверждено центральным методическим советом
Дальневосточного государственного медицинского университета в качестве учебно-методического пособия для студентов, обучающихся
по специальности 060108.65—Фармация
УДК 543(076.5)
ББК 24.4 я 73
Издательство ГБОУ ВПО ДВГМУ, 2012
Оглавление:
Раздел I. Теоретические основы титриметрического анализа……………………………4
1.Основные понятия …………………………………………………………………………4
2. Условные обозначения…………………………………………………………………….6
3.Расчет в титриметрическом анализе………………………………………………………7
4.Способы и приемы титрования. Расчет массы навески анализируемого образца……..9
5. Анализ жидкого образца…………………………………………………………………12
6.Определение среднего значения результатов анализа………………………………….16
7. Способы приготовления стандартных растворов………………………………………16
8. Запись результатов измерений и вычислений в титриметрическом анализе……….17
Раздел II. Задания для самостоятельной работы…………………………………………..19
Тема 1.Гравиметрия…………………………………………………………………………19
Тема 2. Протолитометрия. Приготовление и стандартизация титрованных растворов..31
Тема 3.Протолитометрия. Анализ жидких образцов……………………………………..48
Тема 4. Протолитометрия. Анализ твердых образцов……………………………………55
Тема 5. Перманганатометрия………………………………………………………………62
Тема 6. Йодометрия…………………………………………………………………………75
Тема 7. Броматометрия……………………………………………………………………..90
Тема 8. Нитритометрия……………………………………………………………………101
Тема 9. Седиметрия………………………………………………………………………..114
Тема 10. Комплексонометрия……………………………………………………………..127
Тема 11. Задачи по титриметрическому анализу………………………………………..139
Тема 12. Определение протолитов в неводных средах………………………………….149
Приложение
Таблица 1. Важнейшие кислотно-основные индикаторы……………………………….150
Таблица 2. Плотности и концентрации растворов…………………………………….…151
Таблица 3. Значения коэффициента a для ЭДТА при разных значениях рН………….152
Таблица 4. Логарифмы констант устойчивости комплексов
металлоидикаторов………………………………………………………………………...152
Список литературы………………………………………………………………………...153
Таблица вариантов…………………………………………………………………………154
Раздел I
Теоретические основы титриметрического анализа
1. ОСНОВНЫЕ ПОНЯТИЯ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА.
Аликвотный объем – точно известная часть раствора (анализируемого или стандартного), взятая для титрования.
Индикаторы – органические и неорганические вещества, позволяющие фиксировать точку конца титрования.
Контрольный (холостой) опыт – повторение процедуры химического анализа (титрования) по методике, но без анализируемого вещества, для определения влияния вспомогательных реагентов на правильность результатов титрования с целью введения поправки к результату анализа (титрования).
Кривая титрования – графическое представление процесса титрования, отражающее изменение измеряемого параметра системы от объема титранта.
Концентрация – величина, выражающая относительное содержание данного компонента в растворе.
Концентрация – величина, выражающая относительное содержание данного компонента в растворе.
Концентрация молярная (моль/дм3) – количество моль вещества, содержащихся в 1 дм3 раствора.
Концентрация нормальная (эквивалентная, молярная концентрация эквивалента; моль/дм3) – количество моль эквивалента вещества, содержащихся в 1 дм3 раствора.
Концентрация массовая процентная (массовая доля; %) – масса вещества в граммах, содержащихся в 100 г. раствора.
Концентрация массо - объемная процентная (массо - объемная доля; %) – масса вещества в граммах, содержащихся в 100 см3 раствора.
Коэффициент поправочный – отношение практической (истинной) концентрации раствора титранта к его теоретической концентрации.
Моль – единица количества вещества, содержащая столько реальных или условных частиц, сколько атомов содержится в 0,012 г. углерода – 12.
Молярная масса – масса 1 моль вещества, определяемая как отношение массы вещества в граммах к его количеству в молях (г/моль).
Молярная масса эквивалента – масса 1 моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Метод анализа – краткое определение принципов, положенных в основу анализа вещества.
Методика анализа – подробное описание всех условий и операций, которые обеспечивают получение правильных и воспроизводимых результатов анализа вещества.
Навеска аналитическая – определенная часть пробы, используемая при выполнении аналитического определения.
Проба – часть анализируемого материала, представительно отражающая его химический состав.
Скачок титрования – резкое изменение какого – либо физического или химического свойства системы «определяемое вещество – титрант» вблизи точки эквивалентности, наблюдаемое в интервале 99,9 – 100,1% добавленного титранта.
Стандартное вещество – эталон вещества, химический состав которого точно известен:
а) первичное стандартное вещество – вещество высокой чистоты, используемое для приготовления первичного стандартного раствора и для установления концентрации вторичных стандартных растворов;
б) вторичное стандартное вещество – вещество, содержание активного компонента в котором находят сравнением с первичным стандартным веществом.
Стандартные (титрованные) растворы – растворы с точно известной концентрацией вещества, применяемые в титриметрическом анализа.
а) первичный стандартный раствор – раствор, концентрацию которого находят, исходя из массы первичного стандартного вещества и объема приготовленного из него раствора;
б) вторичный стандартный раствор – раствор, концентрацию которого находят путем стандартизации по первичному стандартному веществу.
Стандартизация – установление точной концентрации вторичного стандартного раствора путем титрования аликвотного объема первичного стандартного раствора или отдельной навески первичного стандартного вещества или путем титрования другого вторичного стандартного раствора известной концентрации.
Стандарт – титр (фиксанал) – строго определенное количество вещества (обычно 0,1 моль эквивалентной массы), помещенное в стеклянную ампулу и служащее для приготовления стандартного раствора.
Титрование – основной прием титриметрического анализа, заключающийся в постепенном добавлении стандартного раствора из бюретки к раствору анализируемого вещества до достижения точки конца титрования.
Титрование реверсивное – титрование раствором определяемого вещества аликвотного объема титранта.
Точка конца титрования – момент резкого изменения какого – либо физического или химического свойства раствора в процессе титрования.
Точка эквивалентности – момент процесса титрования, когда количество добавленного стандартного раствора химически эквивалентно количеству титруемого вещества.
Титрант (титрованный, или рабочий раствор) – стандартный раствор титриметрического метода анализа (см. Стандартный раствор).
Титр (г/см3) – масса вещества (в граммах), содержащая в 1 см3 раствора.
Титр по определяемому веществу (титр соответствия, г/см3) – масса определяемого вещества (в граммах), эквивалентная массе титранта, содержащегося в 1 см3 его раствора.
Фактор эквивалентности в титриметрии – число, обозначающее, какая доля реальной или условной частицы вещества эквивалентна одному иону гидроксония или гидроксила в данной кислотно – основной реакции или одному электрону в данной окислительно – восстановительной реакции.
Число эквивалентности – в протолитической реакции равно числу ионов гидроксония или гидроксила, эквивалентных веществу в данной протолитической реакции, в окислительно – восстановительной реакции равно числу электронов, эквивалентных веществу в данной редокс – реакции.
Эквивалент – относительная масса структурного элемента (атома, иона, молекулы) вещества, эквивалентная в химической реакции 1 атому водорода или 1 электрону.
2. УСЛОВНЫЕ ОБОЗНАЧЕНИЯ.
1. А – определяемое вещество;
2. В – титрант;
3. С – любое вещество;
4. ПСВ – первичное стандартное вещество;
5. ВСВ – вторичное стандартное вещество;
6. М.м. – молярная масса (масса 1 моль вещества в г.)
7. М(1/Z A) – молярная масса эквивалента (г/моль);
8. n – число молей вещества;
9. nэ – число молей эквивалента вещества;
10. f – фактор эквивалентности;
11. z –число эквивалентности;
12. m – масса вещества, г.
12.1. m – масса аналитической навески, г.
12.2. q – массовое содержание вещества в пробе, г.
12.3. mР – масса раствора, г.
13. V – объем раствора, см3
13.1. VA – объем раствора определяемого вещества, см3;
13.2. VB – объем стандартного раствора, см3;
13.3. VTB – теоретический (расчетный) объем, см3;
13.4. Vaл – аликвотный объем раствора, см3;
13.5. VB – средний объем стандартного раствора, затраченного на титрование аликвотных объемов раствора анализируемого образца;
14. W – вместимость мерной колбы, см3;
15. r - плотность раствора, г/см3;
16. CM – молярная концентрация, моль/дм3;
17. CH – молярная концентрация эквивалента (нормальная), моль/дм3;
18. T – титр раствора, г/см3;
18.1. TB – титр стандартного раствора, г/см3;
18.2. TB/A – титр стандартного раствора В по определяемому веществу А, г/см3;
19. K – поправочный коэффициент;
20. w% - массовая доля, % (массовая процентная концентрация);
21. w’% -массо–объемная доля, %(массо – объемная концентрация)
ПРИМЕЧАНИЕ: СТМ, СТН, ТТВ, ТТВ/А - теоретическое значение
концентрации раствора
СМ, СН, ТВ, ТВ/А - практическое значение
 концентрации раствора
концентрации раствора
mТ – масса навески теоретическая (расчетная)
m – масса навески практическая
3. РАСЧЕТЫ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ.
Расчеты в аналитической химии базируются на законах сохранения массы веществ, постоянства состава и эквивалентах.
Молярная масса эквивалента вещества:



где  ,
, 
3.1 СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
3.1.1. Молярная концентрация раствора:

Форма записи: а) СМ (Н2SО4) = 0,1 моль/дм3
б) 0,1 М Н2SО4.
3.1.2. Молярная концентрация эквивалента (нормальная):

Форма записи: а) СН (КМnО4) = 0,1 моль/дм3
б) С (1/5 КМnО4) = 0,1 моль/дм3
в) 0,1 н КМnО4.
3.1.3. Плотность раствора.

3.1.4. Титр:

Форма записи: ТНСI = 0,003646 г/см3.
3.1.5. Титр титранта по определяемому веществу (титр соответствия):
 СВVВ
СВVВ

m(А)г.
Примеры:  = 0,01907 г/см3
= 0,01907 г/см3
 = 0,003152 г/см3.
= 0,003152 г/см3.
Физический смысл титра по определяемому веществу:
титр соответствия хлороводородной кислоты по тетраборату натрия показывает, что 0,01907 г Na2B4O7 ∙10H2O взаимодействует с 1,00 см3 раствора хлороводородной кислоты, нормальная концентрация которой составляет 0,1000 моль/дм3:

Или, титр соответствия перманганата калия по щавелевой кислоте показывает, что 0,003151 г. H2C4O4 ∙2H2O взаимодействует с 1,00 см3 раствора перманганата калия, нормальная концентрация которого составляет 0,0500 моль/дм3:
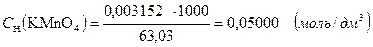
3.1.6. Поправочный коэффициент.

3.1.7. Массовая доля вещества (массовая процентная концентрация):

3.1.8. Массо - объемная доля вещества (массо - объемная концентрация):

4. СПОСОБЫ И ПРИЕМЫ ТИТРОВАНИЯ. РАСЧЕТ МАССЫ НАВЕСКИ АНАЛИЗИРУЕМОГО ОБРАЗЦА И РЕЗУЛЬТАТОВ АНАЛИЗА.
В соответствии с законом эквивалентов вещества взаимодействуют между собой в эквивалентных количествах.
4.1. В титриметрическом анализе применяют способы прямого, косвенного (титрование заместителя) и обратного титрования.
4.1.1. В прямом титровании (титрованию по остатку) определяемое вещество А непосредственно реагирует с титрантом В.
 А + В С
А + В С
Разновидностью прямого титрования является реверсивное титрование, при котором аликвотный объем стандартного раствора титруют раствором анализируемого вещества из бюретки.
 |  |
VB, CB VА
mА или Vал Vал B, CB
прямое реверсивное
В случае, если непосредственное взаимодействие между определяемым веществом и титрантом не удовлетворяет всем требованиям, предъявляемым к химическим реакциям титриметрического анализа, используют косвенное или обратное титрование.
4.1.2. В косвенном (заместительном) титровании титрант В взаимодействует в эквивалентных количествах с заместителем З, образовавшемся в эквивалентном определяемому веществу А количестве после добавления к нему вспомогательного реактива Р.
 АХ + Р З
АХ + Р З
 З + В С
З + В С
4.1.3. В обратном титровании (титровании по остатку) к определяемому веществу А добавляют фиксированное избыточное количество стандартного раствора В1, остаток которого оттитровывают стандартным раствором В2.
 АХ + В1 ИЗБ. С
АХ + В1 ИЗБ. С
 В1 ОСТ + В2 Д
В1 ОСТ + В2 Д
 |
 VB, CB В2
VB, CB В2
 |

АХ + Р З АХ + B1 ИЗБ
заместительное обратное (по остатку)
4.2. При этом во всех способах титрования используют два приема:
· прием титрования отдельной навески анализируемого образца;
· прием пипетирования.
4.2.1. В первом случае точная навеска анализируемого образца растворяется в произвольном объеме растворителя и целиком оттитровывается стандартным раствором. При этом массу теоретической навески рассчитывают, исходя из того, чтобы на её титрование было затрачено приблизительно 15-20 см3 стандартного раствора (VT), т. е. объем, не превышающий объема бюретки. Массу теоретической навески анализируемого образца в прямом и заместительном титровании рассчитывают по формуле:

Теоретический объем раствора анализируемого вещества в приеме титрования отдельной навески рассчитывают по формуле:
 ,
,
где w% - массовая доля в % вещества А в анализируемом растворе;
r - плотность анализируемого раствора, г/см3.
 СВ VВ
СВ VВ
m АХ или Vaл АХ
4.2.2. В приеме пипетирования из точной навески анализируемого образца готовят в мерной колбе раствор с концентрацией, примерно равной концентрации титранта. На титрование берут с помощью пипетки Мора аликвотный объем приготовленного раствора переносят в колбу для титрования и титруют её стандартным раствором.

 W СВ VВ
W СВ VВ
 m АХ или
m АХ или
Vaл АХ Vaл АХ
В приеме пипетирования массу теоретической навески анализируемого образца рассчитывают по формуле:

Теоретический объем раствора анализируемого вещества в приеме пипетирования рассчитывают по формуле:

В приеме титрования отдельной навески по способу обратного титрования массу теоретической навески анализируемого образца и теоретический объем раствора анализируемого образца рассчитывают по формулам:

 ,
,
 где V1 и V2 – теоретические
где V1 и V2 – теоретические
объемы первого и второго титрантов. В2 С2V2
Например: V1 =25, V2 = 15
или V1 =50, V2 = 15 С1V1
m(Vал АХ) + В1ИЗБ.
В таблице 1 приведены формулы, используемые для расчета массового содержания (q) определяемого компонента А в анализируемом образце и формулы расчета навески образца в приеме титрования отдельной навеки и приеме пипетирования при различном способе выражения концентрации титранта.
Массовую долю компонента А (w%) при взятии точной навески образца анализируемого различными способами и приемами, находят по формуле:
 ,
,
где m – навеска образца, г.
5. АНАЛИЗ ЖИДКОГО ОБРАЗЦА.
При анализе жидкого образца следует установить необходимость разбавления его до концентрации титрованного раствора. Для этого определяют приблизительную нормальную концентрацию анализируемого жидкого образца по плотности или путем расчетов, исходя из известного теоретического состава жидкого образца по формуле 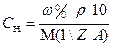 . Если концентрация компонента в анализируемом жидком образце приблизительно равна или 2-4 раза превышает концентрацию титранта, то на титрование берут аликвотный объем этого образца без разбавления. Теоретический объем раствора анализируемого вещества в этом случае рассчитывают по формулам:
. Если концентрация компонента в анализируемом жидком образце приблизительно равна или 2-4 раза превышает концентрацию титранта, то на титрование берут аликвотный объем этого образца без разбавления. Теоретический объем раствора анализируемого вещества в этом случае рассчитывают по формулам:
 для прямого и заместительного
для прямого и заместительного
 для обратного титрования
для обратного титрования
В таких случаях чаще определяют массовое содержание компонента в определенном объеме жидкого образца (например, в 200 см3 жидкой лекарственной формы), или массо – объемную долю, т. е. содержание этого компонента в 100 см3 раствора по формулам, приведенным в табл.1.
Если концентрация определяемого компонента в жидком образце намного превышает концентрацию титрованного раствора, жидкий образец следует разбавить в n =  раз.
раз.
Для этого необходимо приготовить разведение жидкого образца в мерной колбе вместимостью W см3 с концентрацией, приблизительно равной концентрации титранта. Мерную колбу подбирают такую, чтобы её вместимость делилась на соотношение  . Например, в анализируемом жидком образце СН (А) »2,2 моль/дм3,
. Например, в анализируемом жидком образце СН (А) »2,2 моль/дм3,  = 0,05 моль/дм3. Следовательно, анализируемый раствор необходимо разбавить в
= 0,05 моль/дм3. Следовательно, анализируемый раствор необходимо разбавить в  44
44  40 раз в мерной колбе вместимостью 200,00 см3.
40 раз в мерной колбе вместимостью 200,00 см3.
При этом объем анализируемого жидкого образца, который необходимо взять для приготовления W см3 разбавленного раствора с концентрацией СН(В), рассчитываем по формулам:
а)  (см3)
(см3)
б)  (см3)
(см3)
в) 
(т. е. из формулы СН КОНЦ.V КОНЦ. = СН РАЗБ.V РАЗБ.)
Для приготовления разведения можно взять жидкий образец по массе и по объему. В первом случае определяется масса
(mЖ. ОБР.) взятого для разведения V см3 жидкого образца путем взвешивания его в бюксе или мерной колбе. Тогда массовую долю определяемого компонента в жидком образце находят по формуле:

Во втором случае, т. е. при взятии жидкого образца по объему, анализируемый раствор берется пипеткой Мора и переносится в мерную колбу для приготовления W см3 разбавленного раствора. В нашем примере VЖ. ОБР. = 4,5 см3, значит необходимо взять 5,00 см3 пипеткой Мора. В этом случае масса взятого жидкого образца рассчитывается следующим образом: m = Vr. Тогда массовая доля (в %) определяемого компонента в жидком образце рассчитывается по формуле:

Массо - объемную долю компонента А в жидком образце, показывающую количество граммов компонента А в 100 см3 раствора, рассчитывают по формуле:

Таблица 1
ФОРМУЛА РАСЧЕТА РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
| Способ титрования Концентрация титранта | Титрование отдельной навески | Прием пипетирования | ||
| Масса отдельной навески Ах (г.) VА Ах (см3) | Массовое содержание компонента А в образце, г. | Масса навески для приготовления W см3 раствора, г. V Ах (см3) | Массовое содержание компонента А в образце, г. | |
| 1. Прямое Заместительное 1.1 ТВ/А 1.2 СН(В) 1.3 ТВ | 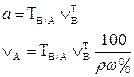
| 
| 
| 
|

| 
| 
| 
| |

| 
| 
| 
|
Таблица 1 (продолжение)
ФОРМУЛЫ РАСЧЕТА РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
| Способ титрования Концентрация титранта | Титрование отдельной навески | Прием пипетирования | ||
| Масса отдельной навески, г. | Массовое содержание компонента А в образце, г. | Масса навески для приготовления W см3 раствора, г. V раствора (см3) | Массовое содержание компонента А в образце, г. | |
| 2. Обратное 2.1 ТВ1/А ТВ2/А 2.2 СН (В1) СН(В2) | 
| 
| 
| 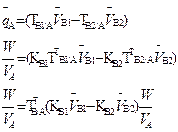
|

| 
| 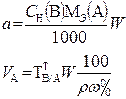
| 
|
6. ОПРЕДЕЛЕНИЕ СРЕДНЕГО ЗНАЧЕНИЯ РЕЗУЛЬТАТОВ АНАЛИЗА.
При проведении анализа путем титрования отдельных навесок образца для каждой навески точно известной массы находят qА или wА % по объему титранта VА, пошедшего на титрование каждой отдельной навески (см. табл. 1). Среднее значение массового содержания или массовой доли компонента А в образце находят как средне арифметическое из n (не менее трех) определений:


В случае, если отдельную навеску жидкого образца брали пипеткой Мора, то усредняют не менее трех объемов титрованного раствора, затраченных на титрование из бюретки.
В приеме пипетирования в формулу расчета qA и wА% ставится среднее значение объема титранта (VB), которое находится как среднее арифметическое объемов титранта, пошедших на титрование отдельных равных аликвотных объемов раствора определяемого вещества:
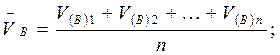
Для расчета  B учитываются те значения VB параллельных определений, разность которых не превышает ± 0,05 см3.
B учитываются те значения VB параллельных определений, разность которых не превышает ± 0,05 см3.
7. СПОСОБЫ ПРИГОТОВЛЕНИЯ СТАНДАРТНЫХ РАСТВОРОВ.
Способ приготовления титрованного раствора зависит от того, чем является исходное вещество, из которого готовят раствор – первичным или вторичным стандартом.
Растворы первичных стандартных веществ готовят по точной навеске (способ 1), а концентрацию первичного стандартного раствора рассчитывают, исходя из массы навески (m) и объема приготовленного в мерной колбе раствора (W).
Вторичные стандартные растворы готовят приблизительной концентрации, а точную концентрацию их устанавливают в процессе стандартизации путем титрования отдельной навески первичного стандартного вещества или аликвоты первичного стандартного раствора (способ 2) или аликвоты другого вторичного стандартного раствора (ВСР), точно известной концентрации (3 способ). В процессе стандартизации могут быть использованы способы прямого, заместительного или обратного титрования.
В табл. 2 приведены формулы для расчета массы навески твердого или объема раствора жидкого стандартного вещества, а также формулы расчета концентрации приготовленного стандартного раствора.
8. ЗАПИСЬ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ И ВЫЧИСЛЕНИЙ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ.
Результаты измерения массы веществ, объема раствора, а также результаты вычислений, проводимых в титриметрическом анализе, определяются целями анализа и точностью используемых измерительных приборов. Результаты измерений и вычислений должны содержать столько значащих цифр, чтобы только последняя из них была недостоверной.
Значащими цифрами являются все цифры, начиная с первой слева, отличной от нуля. Нуль может быть значащим, если он расположен между значащими цифрами или после них.
При измерении массы навески на аналитических весах с точностью ± 0,0001 г. в результате взвешивания десятитысячная доля грамма является недостоверной, но результат должен быть записан с четырьмя цифрами после запятой, например 0,5284 г., а не 0,528 г.
Точность измерения объема раствора бюреткой составляет
± 0,02 см3, поэтому результат должен содержать две значащие цифры после запятой, последняя из которых – недостоверная. Например, 15,12 см3, а не 15,1 см3; 14,08 см3, а не 14,1 см3; 16,00 см3, а не 16,0 и не 16 см3.
Результаты вычислений не могут быть точнее, чем это позволяют измерительные приборы. Поэтому в титриметрическом анализе, в котором используются аналитические весы и бюретки с указанной точностью, результаты вычислений концентрации стандартных растворов, поправочных коэффициентов, титров, массовой доли веществ должны содержать 4 значащих цифры. Например, С(1/2 Н2SО4) = 0,1024 моль/дм3; К(NаОН) = 0,9984;
Т НСI/NaHCO3 = 0.008401 г/см3; w%(А) = 98,34%.
Однако, при проведении ориентировочных вычислений, например, оптимальной навески определяемого или стандартного вещества, для приготовления разведения или титрования, точное значение этих величин не требуется. Вычисления в таком случае проводятся приблизительно и результаты их округляются до меньшего количества значащих цифр.
ФОРМУЛЫ РАСЧЕТОВ ПРИ ПРИГОТОВЛЕНИИ СТАНДАРТНЫХ РАСТВОРОВ. Таблица 4
| Рассчитывае- мая величина | Приготовление ПСР по точной навеске ПСВ (1 способ) | Приготовление ВСР объемом Vр приблизительной конц-ции | Стандартизация приготовленного раствора | ||
| По ПВС(установленному в-ву)2сп | По другому ВСР’ путем титрования его аликвотного объема (способ 3) | ||||
| Титрование отдельной навески ПСВ | Титрование аликвотного объема ПСР | ||||
| Масса навески ПСВ | 
| - | 
| 
| 
|
| Концентрация ПСР | 
| - | - | 
| 
|
| Масса навески твердого ВСВ, г. | - | 
| - | - | 
|
| Масса навески жидкого ВСВ с w%. | - | 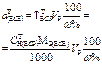
| - | - | 
|
| Объем исходного жидкого ВСВ r, w%, СН(ИСХ) | - | 
| - | - | 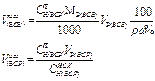
|
| Конц-ция ВСР (прямое,замест-ное титрование) | - | - | 
| 
| 
|
| Конц-ция ВСР (обратное тит-ние) | - | - | - | - | 
|
Раздел II






