Основным состоянием атома кислорода, также как и молекулы, является триплет, т.е. полный электронный спин S =1. Электронная конфигурация атома кислорода:
| 1s2 | ↑↓ | 2s2 | ↑↓ | 2p4 | ↑↓ | ↑ | ↑ |
Создаем новое активное окно. В библиотеке элементов выбираем атом кислорода и переносим его в активное окно. На панели меню редактора GaussView выбираем Calculate → Gaussian Calculation Setup. Устанавливаем следующие параметры расчетов: Job Type - energy, Method – DFT B3LYP 6-31(d)G, Spin – triplet, Job Title – (например, O_DFT_B3LYP_6-31dG_triplet_energy). Нажимаем Submit, при сохранении файла для удобства лучше указывать то же имя файла, что и во вкладке Title. При запуске расчетов появится окно Gaussian03 (рис.2.2), в окне которого отображается текущее состояние расчетов.

Рис.2.2 Окно программного комплекса Gaussian 03
Информация о распределении электронной плотности атомных и молекулярных орбиталей (АО и МО) содержится в output файле с расширением *.chk. После окончания расчетов открываем файл расширением O_DFT_B3LYP_6-31dG_triplet_energy.chk. На панели команд GaussView выбираем редактор молекулярных орбиталей  (табл.1.1). В окне редактора МО отображена диаграмма уровней - распределение электронов по энергетическим уровням молекулярных орбиталей (рис.2.3). Энергия выражена в атомных единицах энергии 1a.u. = 1 Хартри =27.2эВ. Alpha и Beta электроны соответствуют противоположным ориентациям электронных спинов.
(табл.1.1). В окне редактора МО отображена диаграмма уровней - распределение электронов по энергетическим уровням молекулярных орбиталей (рис.2.3). Энергия выражена в атомных единицах энергии 1a.u. = 1 Хартри =27.2эВ. Alpha и Beta электроны соответствуют противоположным ориентациям электронных спинов.
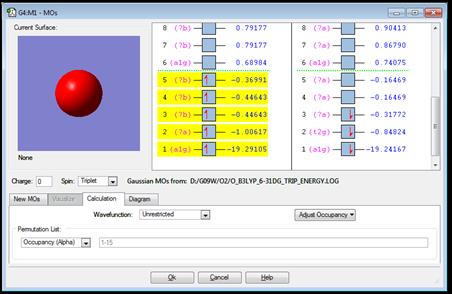
Рис.2.3 Диаграмма уровней атома кислорода в триплетном состоянии.
Переходим во вкладку Visualize, выделяем мышью интересующие орбитали на диаграмме уровней (выбранные МО подсвечиваются желтым цветом) и нажимаем Update. Визуализированные АО представлены на рис.2.4. Для отображения декартовой системы координат, на панели команд выбираем View → Cartesian Axes.
Одной из характеристик атомов и молекулярных структур является потенциал ионизации - минимальная энергия, необходимая для удаления электрона с внешней оболочки на бесконечность. По теореме Купманса, потенциал ионизации определяется как энергия электронов на высшей занятой орбитали HOMO (High Occupied Molecular Orbital), взятая с противоположным знаком.
 (2.12)
(2.12)
Поскольку энергия электрона на 2p↓ орбитали выше, чем на 2p↑, то потенциал ионизации атома кислорода, рассчитанный методом DFT B3LYP 6-31(d)G составляет 0.317 a.u.=8.622 эВ.
Задание 1. Визуализировать электронную плотность атомных орбиталей и соотнести с электронной конфигурацией атома (1s22s12p3) углерода, используя метод DFT B3LYP 6-31(d)G.
| № АО | α-орбиталь | EАО↑, a.u. | β-орбиталь | ЕАО↓, a.u. |
 2p↑ 2p↑
| -0.369 | |||
 2p↑ 2p↑
| -0.446 | |||
 2p↑ 2p↑
| -0.446 |  2p↓ 2p↓
| -0.317 | |
 2s↑ 2s↑
| -1.006 |  2s↓ 2s↓
| -0.848 | |
 1s↑ 1s↑
| -19.291 |  1s↓ 1s↓
| -19.241 |
Рис. 2.4 Атомные орбитали атома кислорода. Масштаб сохранен






