У п'ять пробірок налийте по 1 мл дистильованої води і додайте лакмус. Внесіть у першу пробірку натрій карбонат, у другу – алюміній сульфат, у третю – натрій сульфат, у четверту – натрій ортофосфат. П'ята пробірка служить для порівняння отриманих кольорів. Які з випробуваних солей піддалися гідролізу? Складіть рівняння реакцій гідролізу.
Б) Вплив сили кислоти і основи, що утворюють сіль, на ступінь гідролізу.
В дві пробірки налийте по 0,5 мл розчинів Na2SO3 і Na2СO3 з молярною концентрацією еквівалентів 1 моль/л, додайте в кожну з них по 1 – 2 краплі фенолфталеїну. Порівняйте інтенсивність забарвлення індикатора в обох пробірках. Яка з солей гідролізується в більшій мірі? Відповідь мотивуйте, порівнявши силу кислот Н2SO3 і Н2СO3 (табл.10).
В) Взаємне посилення гідролізу солі слабкої основи сіллю слабкої кислоти.
Налийте в пробірку 5 – 6 крапель розчину алюміній сульфату і додайте такий же об’єм розчину натрій карбонату. Порівняйте спостереження з дослідом 2а. Відзначте виділення бульбашок газу (якого?) і утворення осаду (якого?) та характер середовища. Напишіть молекулярне і йонно-молекулярне рівняння гідролізу солі.
Контрольні питання і задачі
1. Яка величина є кількісною характеристикою кислотності середовища?
2. Обчислити рН розчину з молярною концентрацією оцтової кислоти 0,01 моль/л, в якому ступінь її дисоціації дорівнює 0,042.
3. Які з перерахованих нижче солей піддаються гідролізу: ZnBr2, K2S, Fe2(SO4)3, MgSO4, Cr(NO3)3, K2CO3, Na3PO4, CuCl2. Для кожної з солей, що гідролізується, напишіть в молекулярній та йонно-молекулярній формі рівняння гідролізу по кожному ступеню, вкажіть реакцію середовища розчину солі.
4. У який колір буде забарвлений лакмус у водних розчинах KCN, NH4Cl, K2SO3, NaNO3, FeCl3, Na2CO3, Na2SO4? Відповідь поясніть.
5. Обчисліть рН розчинів, у яких концентрація йонів Н+ (моль/л) дорівнює:
а) 4,6 · 10–7; б) 8,1 · 10–3; в) 2,7· 10–10 (а) 6,70, б) 2,09, в) 9,57).
6. Обчисліть молярну концентрацію йонів Н+ у водних розчинах, якщо концентрація гідроксид-йонів складає: а)10–4; б)3,2 ·10–6; в)7,4 ·10–11. (а)10–10 моль/л, б) 3,12·10–9 моль/л, в) 1,35·10–4 моль/л).
Лабораторна робота № 6
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Теоретична частина. Окисно-відновні реакції характеризуються переходом електронів від одного компонента реакції до іншого. Окиснення – це віддача електронів атомами, йонами або молекулами, внаслідок чого ступінь окиснення елементів, що втратили електрони, зростає:
 – 2ē ® 2
– 2ē ® 2  ;
;  – 2ē ®
– 2ē ®  ;
; 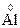 – 3ē ®
– 3ē ®  ;
; 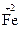 – ē ®
– ē ® 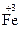 ; 2
; 2  – 2ē ® Br20.
– 2ē ® Br20.
Відновлення – процес приєднання електронів атомами, йонами або молекулами, внаслідок чого ступінь окиснення елементів, що приєднали електрони, зменшується:
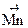 + 2ē ®
+ 2ē ®  ;
;  + 2ē ®
+ 2ē ®  ;
; 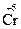 +3ē ®
+3ē ® 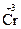 ;
; 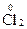 +2ē ® 2
+2ē ® 2 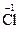 ;
;  + 4ē ® 2
+ 4ē ® 2 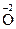 .
.
Речовини, що в окисно-відновних реакціях втрачають електрони, називаються відновниками, а речовини, що приєднують електрони, – окисниками. Ступінь окиснення – це умовний заряд атома в молекулі, обчислений у припущенні, що молекула складається з йонів і в цілому електронейтральна (у ряді випадків ступінь окиснення не збігається з валентністю).
Вплив середовища на перебіг реакції:


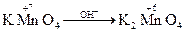
Дослід №1. У 3 пробірки налийте по 1 краплі розчину калій перманганату КМnО4. У першу пробірку додайте 2 – 3 краплі розчину сульфатної кислоти, у другу – дистильованої води, у третю – 4 краплі розчину натрій гідроксиду. В усі пробірки додайте розчин натрій сульфіту. Опишіть спостереження в ході реакцій. Складіть рівняння реакцій і зрівняйте методом електронного балансу.
1____________________
_____________________
_____________________
_____________________
_____________________
2. ___________________
_____________________
_____________________
__________________________________________
3.___________________
_____________________
_____________________
_____________________
_____________________
_____________________
Дослід № 2. До 2 крапель розчину калій йодиду КI долити 2 краплі розчину сульфатної кислоти Н2SО4 і 2 краплі розчину калій йодату КIО3. Описати спостереження в ході реакції. Скласти рівняння реакції і зрівняти методом електронного балансу. Довести наявність вільного йоду за взаємодією з крохмалем.
_____________________
_____________________
_____________________
_____________________
_____________________
_____________________
_____________________
Дослід № 3. До 2 крапель біхромату калію К2Сr2О7 додати 2 краплі розведеної сульфатної кислоти і 2 краплі розчину калій нітриту КNO2. Описати спостереження в ході реакції. Скласти рівняння реакції і зрівняти методом електронного балансу.
_____________________
_____________________
_____________________
_____________________
_____________________
Контрольні питання та вправи
1. Які реакції називаються окисно-відновними?
2. Вкажіть типи окисно-відновних реакцій.
3. Які речовини в окисно-відновних реакціях називаються відновниками, а які – окисниками?
4. Визначте ступінь окиснення Сr в наступних сполуках: К2СrО4, Сr2О3, Fе(СrО2)2, К2Сr2О7, Сr2(SО4)3
5. Укажіть, які з приведених процесів являють собою окиснення, а які – відновлення:
S → SO42–; S → S 2–; Sn → Sn 4+; К → К +; Вr2 → 2Вr–; 2Н+ → Н2; Н2 → 2Н–; СI – → СIО3–; V2+ → VO3–; IО3– → I2; МnО4 – → МnО4 2–.
6. Які з приведених реакцій відносяться до реакцій міжмолекулярного окиснення-відновлення, до реакцій внутрімолекулярного окиснення-відновлення і до реакцій диспропорціонування?
а) 4 КМnО4 + 4 КОН = 4 К2МnО4 + О2 + 2 Н2О; б) Н2SО4 + 2 Н2S = 3 S + 3 Н2О;
в) NН4NО2 = N2 + 3 Н2О; д) 2 Н2О2 = О2 + 2 Н2О; г) 4 Р + 3 КОН + 3 Н2О = РН3 + 3 КН2РО2;
е) 2 КМnО4 + 3 МnSО4 + 4 Н2О = 5 МnО2 + К2SО4+ 2Н2SО4.
7. Методом електронного балансу зрівняйте рівняння реакцій:
1) As + HNO3 + H2O ® H3AsO3 + NO
2) KI + KNO2 + H2SO4 ® I2 + NO + K2SO4 + H2O
3) Sb + HNO3 + HCl ® SbCl3 + NO + H2O
4) C + K2Cr2O7 + H2SO4 ® CO2 + Cr2(SO4)3 + K2SO4 + H2O
5) H2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O
6) SnSO4 + K2Cr2O7 + H2SO4 ® Sn(SO4)2 + Cr2(SO4)3 + K2SO4 + H2O
7) PH3 + KMnO4 + H2SO4 ® H3PO4 + MnSO4 + K2SO4 + H2O
8) HNO2 + KMnO4 + H2SO4 ® HNO3 + MnSO4 + K2SO4 + H2O
9) MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O
10) Al + KClO4 + H2SO4 ® Al2 (SO4)3 + KCl + H2O
11) CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O
12) Cr(OH)3 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
13) Cr(NO3)3 + Br2 + KOH ® K2CrO4 + KBr + KNO3 + H2O
14) Al + NaOH + H2O ® NaAlO2 + H2
15) HgS + HNO3 + HCl ® S + HgCl2 + NO + H2O
16) Fe + KNO3 ® Fe2O3 + N2 + K2O
17) Na2SO3 + KMnO4 + K2SO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O
18) Na2SO3 + KMnO4 + KOH ® Na2SO4 + K2MnO4 + H2O
19) FeSO4 + KMnO4 + KOH ® Fe(OH)3¯ + K2MnO4 + K2SO4
20) FeS2 + HNO3(конц.) ® Fe(NO3)3 + H2SO4 + NO2
21) FeCl2 + H2SO4 ® FeCl3 + SO2 + FeSO4 + H2O
22) KI + HNO3 ® I2 + KNO3 + NO + H2O
23) CuS + HNO3 ® CuSO4 + NO2 + H2O
24) SO2 + KMnO4 + H2O ® H2SO4 + K2SO4 + MnSO4
Лабораторна робота № 7
ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Теоретична частина. У гальванічних елементах окисно-відновні реакції протікають на поверхні електродів. Процеси окиснення і відновлення просторово розділені. Окиснення протікає на аноді, відновлення – на катоді. У гальванічному елементі анодом є електрод, потенціал якого менший, ніж потенціал катода. Анод має заряд “–“, катод – заряд “+”.
Величина електродного потенціалу для металічних електродів залежить від природи металу, концентрації його йонів у розчині електроліту та температури і обчислюється за рівнянням Нернста:  де j0 – стандартний електродний потенціал; R – універсальна газова стала, R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F – стала Фарадея, F = 96500 Кл/моль; CМеz+ - концентрація йонів металу в розчині, моль/л.
де j0 – стандартний електродний потенціал; R – універсальна газова стала, R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F – стала Фарадея, F = 96500 Кл/моль; CМеz+ - концентрація йонів металу в розчині, моль/л.
При Т = 298 К рівняння Нернста має вигляд: j = j0+ 

Гальванічний елемент – пристрій, в якому хімічна енергія окисно-відновної реакції перетворюється на електричну. Гальванічний елемент складається із двох електродів – анода і катода, занурених у розчин або розплав електроліту, електролітичного ключа (сольовий місток) і зовнішньої схеми (металічні провідники та вимірювач напруги чи сили струму).
Електрорушійна сила (ЕРС) процесу для гальванічного елементу визначається як різниця між потенціалами катода Ек і анода Еа: ЕРС = jк – jа.
Прикладом гальванічного елемента є мідно-цинковий елемент Данієля-Якобі, що складається з цинкової та мідної пластинок, занурених в розчини цинк і купрум (ІІ) сульфатів з молярними концентраціями 1 моль/л (рис. 1).
Цинковий електрод є анодом, на якому проходить окиснення цинку: Zno = Zn2+ + 2ē. Мідний електрод – катод, на якому проходить відновлення йонів міді з розчину: Cu2+ + 2ē = Cuo
Сумарне рівняння процесу в йонному вигляді: Zno + Cu2+ = Cuo + Zn2+,
або в молекулярній формі: Zn + CuSO4 = Cu + ZnSO4
Схематичний запис гальванічного елемента: (–) Zn| ZnSO4 || CuSO4| Cu (+).
За стандартних умов ЕРС гальванічного елемента:



Рис. 2. Схема гальванічного елемента Даніеля – Якобі






