Теоретична частина. Хімічні реакції найчастіше супроводжуються тепловими явищами, що вивчаються в особливому розділі хімії – термохімії. У цьому розділі використовують термохімічні рівняння, у яких зазначено тепловий ефект реакції. Тепловий ефект реакції – це кількість теплоти, що виділяється або поглинається в реакції при сталому тиску або об’ємі, причому продукти реакції мають таку ж температуру, що й вихідні речовини. Термохімічні розрахунки виконують за законом Гесса: тепловий ефект хімічної реакції при постійному тиску й об’ємі не залежить від способу її проведення, а залежить лише від початкового та кінцевого стану реагуючих речовин.
Тепловий ефект реакції залежить від природи реагуючих речовин та їх агрегатних станів, тому в термохімічних рівняннях символами (г, р, т) позначають стан речовин – газоподібний, рідкий, твердий. Згідно з наслідком із закону Гесса: DH 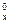 = ∑nпрод. H
= ∑nпрод. H 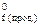 – ∑nвих. H
– ∑nвих. H 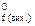 , тобто стандартна ентальпія реакції дорівнює різниці між сумою стандартних ентальпій утворення продуктів реакції (H
, тобто стандартна ентальпія реакції дорівнює різниці між сумою стандартних ентальпій утворення продуктів реакції (H 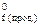 ) та сумою стандартних ентальпій утворення вихідних речовин (H
) та сумою стандартних ентальпій утворення вихідних речовин (H 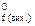 ), помножених на відповідні стехіометричні коефіцієнти (n). Якщо ентальпія реакції є меншою від нуля DH
), помножених на відповідні стехіометричні коефіцієнти (n). Якщо ентальпія реакції є меншою від нуля DH 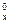 < 0, то реакція екзотермічна (виділення теплоти), якщо ентальпія реакції більше нуля DH
< 0, то реакція екзотермічна (виділення теплоти), якщо ентальпія реакції більше нуля DH 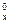 > 0, то реакція ендотермічна (поглинання теплоти).
> 0, то реакція ендотермічна (поглинання теплоти).
Стандартною ентальпією утворення називається кількість теплоти, яка виділяється або поглинається під час утворення 1 моль речовини з простих речовин.
Стандартний стан у термохімії: температура 298 К, тиск 101,325 кПа. Стандартну ентальпію утворення 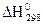 прости х речовин, які перебувають у стабільній модифікації, приймають за нуль.
прости х речовин, які перебувають у стабільній модифікації, приймають за нуль.
Ентропія S – це функція стану, що характеризує прагнення системи до розупорядкування та зниження стійкості. Ентропію реакції можна визначити як різницю між сумою ентропій продуктів реакції та сумою ентропій вихідних речовин DS 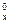 = ∑nпрод. S
= ∑nпрод. S 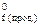 – ∑nвих. S
– ∑nвих. S 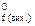 .
.
Енергія Гіббса DG є критерієм напрямку перебігу процесу. Якщо DG < 0 – процес самодовільний, якщо DG = 0, то система перебуває у стані рівноваги, якщо DG > 0 – процес несамодовільний. Енергія Гіббса також підпорядковується наслідку закону Гесса:
DGx = ∑nпрод. 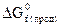 – ∑nвих.
– ∑nвих. 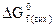 .
.
Дослід 1. Визначення теплового ефекту хімічної реакції
Обладнання та реактиви: калориметр, циліндр, термометр, розчин з молярною концентрацією натрій гідроксиду 1 моль/л, розчин з молярною концентрацією хлоридної кислоти 1 моль/л.
Хід роботи
1. Зважте внутрішню склянку калориметра на технохімічних вагах.
2. Відміряйте циліндром 50 мл розчину натрій гідроксиду (NaOH), внесіть його в склянку і визначте температуру.
3. Відміряйте циліндром 50 мл розчину хлоридної кислоти (HCl).
4. Обполоскавши термометр дистильованою водою, опустіть його в розчин HCl і визначте температуру.
5. Розчин кислоти влийте у розчин лугу і простежте за зміною температури. Запишіть максимальну температуру розчину.
6. Отримані дані занесіть у таблицю 1.
Таблиця 1
| Маса склянки, г | Об’єм, мл | Температура, 0C | Загальна маса розчину (mp), г | ||||
| HCl | NaOН | початкова HCl, tпоч | початкова NaOH, tпоч | розчину, tmаx | Dt = tmаx – tпоч | ||
7. Виконайте розрахунки:
7.1. Теплота, що виділяється чи поглинається в калориметрі, розраховується за формулою:
Q = (mp · Cp + mск · Сск) · Dt, де mp – маса розчину (г), Cp – питома теплоємність розчину дорівнює питомій теплоємності води, тобто 4,184 Дж/(г·К), mск – маса склянки (г), Сск – питома теплоємність скла дорівнює 0,753 Дж/(г·К).
_____________________
_____________________7.2. Обчисліть кількість еквівалентів речовини (кислоти чи лугу), що приймає участь в реакції
__________________________________________7.3. Обчисліть теплоту нейтралізації для 1 моль еквівалентів кислоти (чи лугу).
____________________________________________________________________________ DН = – Q
7.4. Обчисліть тепловий ефект реакції нейтралізації одного еквівалента сильної кислоти (чи лугу). Обчисліть теоретичне значення теплового ефекту реакції Н+(р) + ОН–(р) = Н2О(р) за стандартними величинами ентальпії утворення речовин (DН 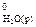 = –286,0 кДж/моль; DН
= –286,0 кДж/моль; DН 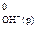 = – 230,2 кДж/моль; DН
= – 230,2 кДж/моль; DН 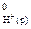 = 0).
= 0).
__________________________________________
8. Визначте відносну похибку досліду за формулою: 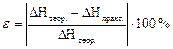
Висновок: ________________________________
_____________________
Контрольні питання та вправи
1. Що вивчає термохімія?
2. Дайте визначення тепловому ефекту реакції. Назвіть типи хімічних реакцій за тепловими ефектами?
3. Сформулюйте закон Гесса та його наслідки.
4. Як називаються рівняння, у яких зазначено тепловий ефект реакції?
5. Як визначити тепловий ефект реакції за стандартними ентальпіями утворення?
6. Від чого залежить тепловий ефект реакції?
7. Які параметри стандартного стану?
8. Що характеризує ентропія?
9. За значенням якої термодинамічної функції можна визначити напрямок перебігу процесу?
10.Визначте стандартну ентальпію утворення фосфіну РН3, користуючись рівнянням:
2РН3(г.) + 4О2(г.) = Р2О5(кр.) + 3Н2О(р.) DН0 = –2360 кДж
11. Обчисліть значення 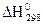 реакцій перетворення глюкози за стандартними ентальпіями утворення речовин: а) С6Н12О6 (к.) = 2С2Н5ОН (р) + 2СО2 (г.);
реакцій перетворення глюкози за стандартними ентальпіями утворення речовин: а) С6Н12О6 (к.) = 2С2Н5ОН (р) + 2СО2 (г.);
б) С6Н12О6 (к.) + 6О2 (г.) = 6СО2 (г.) + 6Н2О (р.)
Яка з цих реакцій поставляє організму більше енергії?
12. Визначте 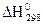 утворення етилену, використовуючи дані:
утворення етилену, використовуючи дані:
1) С2H4(г.) + 3О2 (г.) = 2СО2 (г.) + 2Н2О (г.); 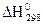 = –1323 кДж.
= –1323 кДж.
2) С (графіт) + О2 (г.) = СО2 (г.); 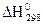 = – 393,5 кДж.
= – 393,5 кДж.
3) Н2(г.) + ½O2(г.) = Н2O(г.) 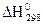 = –241,8 кДж.
= –241,8 кДж.
13. Обчисліть значення 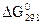 реакцій та визначте, які з них можливі в стандартних умовах при 25 оС:
реакцій та визначте, які з них можливі в стандартних умовах при 25 оС:
а) Cu(кр.) + ZnO(кр.) = CuO(кр.) + Zn(кр.); в) N2(г.) + 1/2O2(г.) = N2O(г.);
б) 4HCl(г.) + O2(г.) = 2Cl2(г.) + 2H2O(р.); г) Fe2O3(кр.) + 3CO(г.) = 2Fe(кр.) + 3CO2(г.)
14. Обчисліть значення 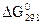 та визначте, які з оксидів можуть бути відновлені алюмінієм при 298К: СаО, FeO, CuО, РbO, Fe2O3, Cr2O3.
та визначте, які з оксидів можуть бути відновлені алюмінієм при 298К: СаО, FeO, CuО, РbO, Fe2O3, Cr2O3.
Таблиця 2






