Обладнання та реактиви: штатив із пробірками, розчин з молярною концентрацією ферум (ІІІ) хлориду 0,1 моль/л, розчин з молярною концентрацією амоній роданіду 0,1 моль/л, насичений розчин ферум (ІІІ) хлориду, насичений розчин амоній роданіду.
Хід роботи: Досліджуємо реакцію: FeCl3 + 3NH4SCN 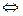 Fe(SCN)3 + 3NH4Cl
Fe(SCN)3 + 3NH4Cl
Fe(SCN)3 забарвлено в криваво-червоний колір, інші речовини – безбарвні чи слабко забарвлені, тому зміна концентрації Fe(SCN)3 позначиться на зміні забарвлення розчину. Це дозволяє спостерігати за зсувом рівноваги. До 20 мл дистильованої води додати 1,5 мл розчину FeCl3 і 0,5 мл розчину NH4SCN. Отриманий розчин налити у 4 пробірки і додати в першу насичений розчин FeCl3, у другу – насичений розчин NH4SCN, у третю – кристалічний NH4Cl. Четверта пробірка – контроль.
Таблиця 5
| № пробірки | Розчин, що доданий | Зміна інтенсивності забарвлення (посилення чи ослаблення) | Напрямок зсуву рівноваги (вліво, вправо) |
| нас.FeCl3 | |||
| нас.NH4SCN | |||
| кр. NH4Cl |
Порівнюючи інтенсивність забарвлення з кольором розчину в контрольній пробірці, і, використовуючи правило Ле-Шательє, поясніть зміну забарвлення розчинів.
Висновок: _____________________________________________________
Контрольні питання та вправи
1. Що вивчає хімічна кінетика? Чим визначається швидкість реакцій?
2. Які фактори впливають на швидкість реакції і константу швидкості реакції?
3. Приведіть математичний вираз закону дії мас.
4. В чому полягає фізичний зміст константи швидкості реакції?
5. Приведіть математичний вираз залежності швидкості реакції від температури.
6. Що показує температурний коефіцієнт швидкості реакції?
7. Як визначити енергію активації?
8. Які процеси називаються оборотними?
9. Що є критерієм перебігу самодовільних хімічних реакцій?
10. Як змінюється рівноважний вихід продуктів реакції від температури та тиску? Приведіть приклади.
11. Обчисліть значення константи швидкості реакції А + В = АВ, якщо при концентраціях речовин А і В, що дорівнюють відповідно 0,05 і 0,01 моль/л, швидкість реакції становить 5×10–5 моль/(л·хв.). (0,1 моль/(л·хв.)
12. У скільки разів зміниться швидкість реакції 2А + В = А2В, якщо концентрацію речовини А збільшити у 2 рази, а концентрацію речовини В зменшити у 2 рази?
13. Як зміниться швидкість реакції 2NО(г.) + O2(г.) = 2NO2 (г.), якщо: а) зменшити об’єм системи у 3 рази; б) збільшити концентрацію NО у 3 рази?
14. Обчисліть температурний коефіцієнт швидкості реакції, якщо при збільшенні температури на 30 оС швидкість реакції зросла у 15,6 рази. (2,5 рази)
15. Як вплине на рівновагу наступних реакцій а) збільшення тиску, б) збільшення температури?
1) 2Н2(г.) + O2(г.) = 2Н2O(г.) DН0 = – 483,6 кДж;
2) СаСО3 (кр.) = СаО(кр.) + CO2(г.) DН0 = 179 кДж
16. У системі СО + С12 = СОС12 концентрацію СО збільшили від 0,03 до 0,12 моль/л, а концентрацію хлору – від 0,02 до 0,06 моль/л. У скільки разів зросла швидкість прямої реакції?
17. Температурний коефіцієнт швидкості деякої реакції дорівнює 2,3. У скільки разів збільшиться швидкість цієї реакції, якщо підвищити температуру на 25 градусів?
18. У стані рівноваги в системі N2 (г.) + 3Н2 (г.) = 2NH3 (г.); DH = – 92,4 кДж концентрації речовин, що беруть участь у реакції, становлять: с(N2) = 3 моль/л; с(H2) = 9 моль/л; с(NH3) = 4 моль/л. Визначте: а) вихідні концентрації Н2 і N2; б) у якому напрямку зміститься рівновага з ростом температури? в) у якому напрямку зміститься рівновага, якщо зменшити об’єм реакційної посудини?






