Між густиною розчину і концентрацією розчиненої речовини існує безпосередня залежність. Для кислот, розчинених основ і солей, які найбільш часто застосовуються, ця залежність установлена і дається в довідниках у вигляді таблиці (табл. 7,8). Внаслідок чого визначення концентрації розчиненої речовини в межах точності 0,5 % може бути проведено шляхом експериментального вимірювання густини розчину, а потім находження концентрації речовини в таблиці. Густину розчину визначають частіше всього за допомогою ареометра. Для цього розчин, який досліджується, наливають в скляний циліндр. Обережно занурюють в нього по черзі ареометри, підбирають такий з них, при якому рівень рідини знаходиться в межах його шкали. При цьому ареометр не повинен торкатися стінок циліндра (рис.1)
 Рис. 1. Положення ареометра у циліндрі з розчином і відлік по шкалі ареометра
Рис. 1. Положення ареометра у циліндрі з розчином і відлік по шкалі ареометра
| 2. Приготування розчину із твердої речовини та рідкого розчинника Н2О Приготуйте 50 мл розчину з масовою часткою речовини, яку вкаже викладач. Зробіть розрахунок маси речовини, що повинна бути в розчині. Зважте розраховану масу речовини, висипте в склянку з водою (~ 10 – 15 мл), перемішуючи скляною паличкою до повного розчинення. Якщо потрібно, підігрійте, а потім знову охолодіть до кімнатної температури і перенесіть розчин в циліндр, мензурку чи мірну колбу. Потім долийте воду до об'єму 50 мл і знову розчин перемішайте. Визначте відносну густину розчину ареометром і порівняйте її з даними по довіднику. 3. Приготування розчину певної концентрації методом розбавлення Приготуйте 50 мл розчину з молярною концентрацією еквівалентів сульфатної кислоти 0,1 моль/л із більш концентрованого розчину. 1. За допомогою ареометра визначте густину вихідного розчину кислоти. 2. За табл. 7 знайдіть масову частку цього розчину. |
На рис. 1 показання ареометра відповідає відносній густині 1,124. Якщо у таблиці відносних густин величина 1,124 відсутня, а наведено близькі їй величини, як, наприклад, для розчину сульфатної кислоти,
| ρ | 1,120 | 1,130 |
| w | 17,01 | 18,31 |
то масову частку знаходять методом інтерполяції (визначення проміжної величини за двома відомими крайніми). Для цього роблять наступні розрахунки:
 а) Знаходять різницю величин відносних густин і концентрацій за табличними даними: 1,130 18,31 %
а) Знаходять різницю величин відносних густин і концентрацій за табличними даними: 1,130 18,31 %
1,120 17,01 %
 0,010 1,30 %
0,010 1,30 %
б) Знаходять різницю між величиною, що визначена ареометром, і меншою табличною:
1,124 – 1,120 = 0,004.
Складають пропорцію: 0,010……1,30
0,004……. х
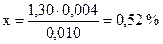
в) Знайдене число додають до меншої величини концентрації, узятої з таблиці:
17,01 + 0,52 = 17,53.
3. Розрахуйте, який об’єм цієї кислоти необхідно взяти для приготування 50 мл розчину з молярною концентрацією еквівалентів сульфатної кислоти 0,1 моль/л.
4. В мірну чисту колбу на 50 мл внесіть частину (≈ 25 мл) дистильованої води.
5. Відміряйте об’єм концентрованого розчину кислоти піпеткою, а потім поступово улийте його в колбу при постійному перемішуванні рідини рухом колби. Якщо розчин дуже нагрівається за рахунок гідратації кислоти, то його слід охолоджувати на повітрі або холодною водою до кімнатної температури.
6. Доведіть об’єм одержаного розчину до мітки по нижньому меніску. Останні порції води додайте по краплям. Колбу закрийте пробкою і обережно перемішайте, перевертаючи колбу дном угору. Зробіть етикетку з назвою розчину речовини, розчин зберігайте для подальшої роботи.






