Теоретична частина. Хімічна кінетика вивчає швидкість і механізм перебігу хімічних процесів. Швидкість реакцій визначається зміною концентрації реагуючих речовин в одиницю часу. Концентрацію звичайно виражають числом молів у 1 л розчину, час – у секундах. Швидкість реакції залежить від природи реагуючих речовин і умов протікання реакції: концентрації реагентів, температури, присутності каталізаторів, поверхні розділу фаз у гетерогенній системі, а також від тиску, якщо реагенти – гази, тому що в цьому випадку зі зміною тиску змінюється концентрація реагентів. Залежність швидкості реакції від концентрації для елементарних процесів виражається законом дії мас: швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, які зведені у ступінь їх стехіометричних коефіцієнтів.
Для реакції aА + bВ → dD + fF швидкість виражається рівнянням v = k × сa(A) × сb(B),
де с(A), с(B)– молярні концентрації речовин (моль/л), k – константа швидкості, що залежить від природи речовини, температури, каталізаторів і не залежить від концентрації реагуючих речовин. Якщо в реакції, крім газу чи рідини, бере участь також тверда речовина, концентрація якої постійна, то швидкість реакції змінюється тільки в залежності від концентрації газів і розчинних речовин, тому що маса твердої речовини не впливає на швидкість реакції.
При підвищенні температури на кожні 10 °C швидкість реакції зростає в 2 – 4 рази (температурний коефіцієнт). Якщо відома швидкість реакції при температурі t1 і температурний коефіцієнт, то швидкість реакції при будь-якій температурі приблизно може бути обчислена за формулою Вант-Гоффа: 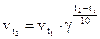 .
.
Енергія активації – мінімальна надлишкова енергія, яку повинні мати молекули по відношенню до значення середньої енергії реагуючих молекул для того, щоб реакція стала можливою. Залежність константи швидкості реакції від температури визначається за рівнянням Арреніуса. ln 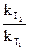 =
= 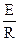
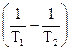
Усі хімічні реакції можна розділити на оборотні і необоротні. Перші протікають одночасно в прямому і зворотному напрямках, але з різною швидкістю. Через якийсь час після їхнього початку швидкості прямої і зворотної реакцій стають однаковими і настає хімічна рівновага. У принципі всі хімічні реакції оборотні, однак у визначених умовах реакція протікає в одному напрямку до повного зникнення вихідних речовин. Такі реакції є необоротними. До них відносяться процеси, що супроводжуються випаданням осаду, виділенням газу, утворенням малодисоціюючих речовин, а також процеси, що супроводжуються дуже великим виділенням теплоти. Усякий самодовільний процес супроводжується надлишком енергії Гіббса DG; тому критерієм протікання хімічної реакції служить нерівність D G < O. Коли наступить рівновага, ця величина досягає мінімуму, тобто критерієм рівноваги є рівність DG = 0. Величина DG зв'язана з тепловим ефектом реакції рівнянням: DG=DН–ТDS, де DS – зміна ентропії в процесі. Значення DG і DS залежать від концентрації реагуючих речовин. Тому для зіставлення різних реакцій і для характеристики впливу температури на процес необхідно користатися якими-небудь порівнянними станами. У якості останніх приймають стан реакційної суміші, у якій концентрація кожної речовини дорівнює одиниці. Такі умови називають стандартними, а стандартні величини позначаються індексом ° (наприклад, DG °).
Для будь-якої реакції aА + вВ ↔ fF + dD, у стані рівноваги виконується співвідношення:
K = 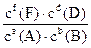 , де
, де 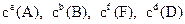 – концентрації речовин у момент рівноваги, K – константа хімічної рівноваги, що залежить від температури.
– концентрації речовин у момент рівноваги, K – константа хімічної рівноваги, що залежить від температури.
Напрямок зсуву рівноваги в залежності від зміни температури, концентрації чи тиску визначається принципом Ле-Шательє: якщо на систему, що знаходиться у стані рівноваги, подіяти ззовні яким-небудь фактором (зміна концентрації, температури або тиску), то у системі виникають процеси, що зменшують ефект цього впливу. Так, при підвищенні температури рівновага зміщується у бік реакції, що йде з поглинанням тепла. При підвищенні тиску рівновага зміщується у бік тих реакцій, що зменшують об’єм системи і т.ін.






