Молярна маса еквівалентів кислоти (МЕК) – відношення молекулярної маси кислоти до основності, яка визначається кількістю атомів Гідрогену, що беруть участь у реакції.
МЕК =  , (г/моль).
, (г/моль).
Для реакції H2SO4 + 2NaOH = Na2SO4 + 2H2O МЕ(H2SO4) = М(Н2SO4)/nН = 98/2 = 49 г/моль, а для реакції H2SO4 + NaOH = NaНSO4 + H2O МЕ(H2SO4) = М(Н2SO4)/nН = 98/1 = 98 г/моль.
Молярна маса еквівалентів основи (МЕО) – відношення молекулярної маси основи до кислотності, яка визначається кількістю гідроксогруп, що вступають у реакцію:
МЕО = 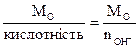 , (г/моль).
, (г/моль).
МЕ(Сa(OH)2) = М(Сa(OH)2)/n ОН– = 74/2 = 37 г/моль.
Молярна маса еквівалентів солі (МЕС) – відношення молекулярної маси солі до добутка кількості атомів металу, що вступають у реакцію, на їх валентність:
МЕС =  , (г/моль).
, (г/моль).
МЕ(Al2(SO4)3) = М(Al2(SO4)3)/(В·n)= 342/(2·3) = 57 г/моль.
Молярна маса еквівалентів оксиду (МЕОк) знаходиться аналогічно до молярної маси еквівалентів солі або як сума молярних мас еквівалентів елемента і Оксигену:
МЕОк = 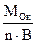 , (г/моль).
, (г/моль).
МЕ(Al2O3) = (Al2O3)/(В·n)=102/(2·3) = 17 г/моль, МЕ(Al2O3) = ME(Al) + ME(O2) = (27/3) + 8 = 17 г/моль.
Для газоподібних речовин користуються молярними об'ємами еквівалентів (VЕ). VЕ(Н2) = 11,2 л/моль, VЕ(О2) = 5,6 л/моль, VЕ(Сl2) = 11,2 л/моль.
Окисний еквівалент – відношення молекулярної маси окисника до кількості електронів, що він приймає в даній окисно-відновній реакції. Відновний еквівалент – відношення молекулярної маси відновника до кількості електронів, що віддані в даній реакції.
Електрохімічний еквівалент – відношення хімічного еквівалента речовини, що виділилася на електроді, до сталої Фарадея (F).
Основні закони хімії
Закон збереження маси: в результаті хімічних перетворень сума мас речовин до реакції і сума мас речовин після реакції однакова.
Закон збереження енергії: будь-яка енергія не зникає і не виникає, а тільки одні її види переходять в інші.
Закон сталості складу: кожна речовина має постійний якісний і кількісний склад незалежно від способів її одержання. Речовини, що отримані різними способами, але які мають той самий якісний і кількісний склад, мають однакові хімічні властивості.
Закон кратних відношень: якщо два елементи утворюють один з одним кілька хімічних сполук, то маси одного елемента, що приходяться на ту саму масу іншого елемента, відносяться між собою як невеликі цілі числа.
Закон об'ємних відношень: об'єми взаємодіючих газоподібних речовин відносяться між собою і до об'ємів продуктів реакції, як невеликі цілі числа.
Закон Авогадро (1811 р.): у рівних об'ємах різних газів при однакових умовах міститься однакове число часток (молекул, атомів, йонів).
Наслідки: 1. Моль будь-якого газу при нормальних умовах займає об'єм 22,4 л.
2. Моль будь-якого газу за нормальних умов містить 6,02 · 1023 часток (стала Авогадро NА).
Закон еквівалентів: 1. хімічні елементи сполучаються один з одним, а речовини реагують і утворюються в еквівалентних кількостях. 2. Маси (об'єми) речовин, що реагують, пропорційні молярним масам (об'ємам) їхніх еквівалентів: 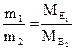
Контрольні питання та вправи
1. Обчисліть молярну масу еквівалентів Нітрогену в оксидах N2O, NO, NO2.
2. Обчисліть молярну масу еквівалентів металу в сполуках: Mn2O7, Mg2P2O7, Ba(OH)2, Ca3(PO4)2.
3. Обчисліть молярну масу еквівалентів металу, якщо при взаємодії 7,2 × 10–3 кг металу з хлором було отримано 28,2 × 10–3 кг солі. Молярна маса еквівалентів хлору 35,45 г/моль. (12,15 г/моль)
4. При відновленні 5,1 г оксиду металу(ІІІ) утворилось 2,7 г води. Визначте молярну масу еквівалентів металу і атомну масу металу. Молярна маса еквівалентів води дорівнює 9 г/моль. (9 г/моль, 27 г/моль)
5. На нейтралізацію 10 г лугу витрачено 9,9 г хлоридної кислоти. Обчисліть молярну масу еквівалентів лугу.
6. При пропущенні сірководню крізь розчин, який містить 2,98 × 10–3 кг хлориду металу(І), утворюється 2,2 × 10–3 кг сульфіду. Обчисліть молярну масу еквівалентів металу. (39 г/моль)
7. Обчисліть молярну масу еквівалентів металу, 1 г якого витісняє з кислоти 700 мл водню, обмірюваного при нормальних умовах.
8. Визначте молярну масу еквівалентів металу, 1 г оксиду якого утворює 1,81 г сульфату цього металу.
9. Визначте молярну масу еквівалентів води в її реакції: а) з калієм; б) з калій оксидом.
10. При згорянні 15 г металу утворюється 28,32 г оксиду металу. Обчисліть молярну масу еквівалентів металу.
11. Визначте кількість кальцій гідрофосфату, що утвориться при взаємодії 3,7 г кальцій гідроксиду з 5,88 г ортофосфатної кислоти.
Класи неорганічних сполук
Прості речовини. Молекули складаються з атомів одного виду (атомів одного елемента). У хімічних реакціях не можуть розкладатися з утворенням інших речовин.
Різкої границі між металами і неметалами нема, тому що є прості речовини (іноді їх виділяють в окремий клас металоїдів), що виявляють двоїсті властивості.
Складні речовини (хімічні сполуки). Молекули складаються з атомів різного виду (атомів різних хімічних елементів). У хімічних реакціях розкладаються з утворенням декількох інших речовин.
Оксиди – речовини, що складаються з двох елементів, один з яких Оксиген із ступенем окиснення –2. У цих сполуках усі атоми Оксигену безпосередньо зв'язані з атомами більш електропозитивних елементів, а співвідношення компонентів відповідає правилам валентності.
За хімічними властивостями оксиди поділяють на три групи: основні, кислотні, амфотерні.
| Оксиди | |
| Несолетворні (байдужі або індиферентні) | CO, N2O, NO |
| Солетворні | Основні –оксиди металів, у яких останні виявляють невеликий ступінь окиснення +1, +2 (їм відповідають основи): Na2O; MgО; CuО |
| Амфотерні –оксиди, які залежно від умов виявляють і основні, і кислотні властивості: ZnО; Al2O3; Cr2O3 | |
| Кислотні –оксиди неметалів і металів зі ступенем окиснення від +5 до +7, (їм відповідають кислоти): SO2; SO3; P2O5; Mn2O7 |
Одержання
1. Взаємодія простих і складних речовин з киснем: 4P + 5O2 →2P2O5; CH4 + 2O2 → CO2 + 2H2O
2. Розкладання деяких оксигенвмісних речовин (основ, кислот, солей) при нагріванні:
Cu(OH)2 –t°→ CuO + H2O; (CuOH)2CO3 –t°→ 2CuO + CO2 + H2O; 2Pb(NO3)2 –t°→ 2Pb + 4NO2 + O2
Хімічні властивості
| Основні оксиди | Кислотні оксиди |
| 1. Взаємодія з водою | |
| Утвориться основа: Na2O + H2O → 2NaOH; CaО + H2O → Ca(OH)2 | Утвориться кислота: SO3 + H2O → H2SO4; P2O5 + 3H2O → 2H3PO4 |
| 2. Взаємодія з кислотою | Взаємодія з основою |
| утвориться сіль і вода | |
| MgО+H2SO4°→MgSO4+H2O CuО+2HCl°→CuCl2+H2O | CO2+Ba(OH)2→BaCO3+H2O SO2+2NaOH→Na2SO3+H2O |
| Амфотерні оксиди взаємодіють | |
| з кислотами як основні: ZnО + H2SO4→ZnSO4+ H2O | з основами як кислотні: ZnO+2NaOH→Na2ZnO2+H2O ZnO+2NaOH+H2O→Na2[Zn(OH)4] |
| 3. Взаємодія основних і кислотних оксидів між собою: Na2O + CO2 ® Na2CO3 | |
| 4. Відновлення до простих речовин: 3CuO + 2NH3 → 3Cu + N2 + 3H2O; P2O5 + 5C → 2P + 5CO |
Кислоти – складні речовини, що складаються з атомів Гідрогену та кислотного залишку.
Класифікація 1. За складом: безоксигенові і оксигенвмісні.
2. За кількістю атомів Гідрогену, здатних заміщатися на метал: одно-, дво-, триосновні.
| Безоксигенові: | Назва солі | Оксигенвмісні: | Назва солі | ||
| HCl – хлоридна (соляна) | одноосновна | хлорид | H2CO3 – карбонатна | двоосновна | карбонат |
| HBr – бромідна | одноосновна | бромід | H2SO3 – сульфітна | двоосновна | сульфіт |
| HI – йодидна | одноосновна | йодид | H2SO4 – сульфатна | двоосновна | сульфат |
| HF – флуоридна (плавикова) | одноосновна | флуорид | H3PO4 – ортофосфатна | триосновна | ортофосфат |
| H2S – сульфідна | двоосновна | сульфід | H2SiО3 – силікатна | двоосновна | силікат |
| H2Sе – селенідна | двоосновна | селенід | HNO3 – нітратна | одноосновна | нітрат |
Одержання
1. Взаємодія кислотного оксиду з водою (для оксигенвмісних кислот):
SO3 + H2O → H2SO4; P2O5 + 3H2O → 2H3PO4.
2. Взаємодія водню з неметалом і наступним розчиненням отриманого продукту у воді (для безоксигенових кислот): H2 + Cl2 → 2HCl; H2 + S → H2S.
3. Реакціями обміну солі з кислотою: Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3 Na2SiО3 + 2HCl → H2SiО3↓ + 2NaCl 2NaCl(тв.) + H2SO4(конц.) –t°® Na2SO4 + 2HCl↑
Хімічні властивості
1. Взаємодія з основами (реакція нейтралізації): H2SO4 + 2KOH → K2SO4 + 2H2O
2. Взаємодія з основними оксидами: CuO + 2HNO3 –t°→ Cu(NO3)2 + H2O
3. Взаємодія з металами, що стоять у ряді напруг до Гідрогену: Zn + 2HCl → ZnCl2 + H2↑;
4. Взаємодія з солями з утворенням газу чи осаду:
H2SO4 + BaCl2 → BaSO4↓ +2HCl 2HCl + K2CO3 → 2KCl + H2O + CO2↑
Основи – складні речовини, в яких атоми металів з'єднані з однією чи декількома гідроксидними групами.
Класифікація
| Розчинні у воді (луги): LiOH, CsOH, NaOH, KOH, RbOH, Ca(OH)2, Ba(OH)2 | Нерозчинні: Fe(OH)3, Cu(OH)2, Аl(OH)3 |
Кількість гідроксидних груп у молекулі основи означає її кислотність.
| Однокислотні: LiOH, NaOH, KOH, RbOH, CsOH, | Двокислотні: Ca(OH)2, Ba(OH)2, Cu(OH)2 | Трикислотні: Аl(OH)3, Fe(OH)3, |
Одержання
1. Реакції активних металів (лужних і лужноземельних металів) з водою:
2Na + 2H2O → 2NaOH + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑
2. Взаємодія оксидів активних металів з водою: BaO + H2O → Ba(OH)2
3. Електроліз водних розчинів солей 2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
Хімічні властивості
| Луги | Нерозчинні основи | |
| 1. Взаємодія з кислотними оксидами | ||
| 2KOH + CO2® K2CO3+ H2O; KOH + CO2 ® KHCO3 | –– | |
| 2. Взаємодія з кислотами (реакція нейтралізації) | ||
| NaOH+HNO3®NaNO3+H2O | Cu(OH)2 + 2HCl ® CuCl2 + 2H2O | |
| 3. Обмінна реакція з солями | ||
| Ba(OH)2+K2SO4®2KOH+BaSO4↓; 3KOH+Fe(NO3)3®Fe(OH)3↓+3KNO3 | –– | |
| 4. Термічний розпад | ||
| –– | Cu(OH)2 –t°® CuO + H2O | |
Амфотерні – гідроксиди, які при дисоціації утворюють одночасно і катіони Гідрогену Н+, і гідроксид–йони ОН–. Прикладом можуть бути Al(OH)3, Zn(OH)2, Cr(OH)3, Be(OH)2, Ge(OH)2, Sn(OH)4, Pb(OH)2, тощо. Al3+ + 3OH– = Al(OH)3  H2O + Al(OH)3 = [Al(OH)4]– + H+,
H2O + Al(OH)3 = [Al(OH)4]– + H+,
де [Al(OH)4]– – гідроксокомплекс алюмінію, який може також існувати у вигляді [Al(OH)4(H2O)2]–.
Солі – складні речовини, що складаються з атомів металу та кислотних залишків. З точки зору теорії електролітичної дисоціації солі – електроліти, які при дисоціації утворюють катіони металів (або групу NH4+) і аніони кислотних залишків. Наприклад: NaCl = Na+ + Cl–.
Класифікація
| Солі | Приклад | Назва | Солі | Приклад | Назва |
| Середні | Na2SO4 | натрій сульфат | Подвійні | KAl(SO4)2 | алюміній калій дисульфат |
| Кислі | NaHCO3 | натрій гідрогенкарбонат | Змішані | CaOCl2 | кальцій оксид хлорид |
| Основні | Fe(OH)2Cl | ферум(ІІІ) дигідроксид хлорид | Комплексні | [Ag(NH3)2]Br | диамінаргентум бромід |
Середні солі (нормальні) – продукти повного заміщення атомів Гідрогену у кислотах на атоми металу, або гідроксидних груп в основах на кислотні залишки. При дисоціації дають тільки катіони металу (чи NH4+): Na2SO4 ⇄ 2Na+ +SO42–
Більшість способів одержання солей засновано на взаємодії речовин із протилежними властивостями:
1. металу з неметалом: 2Na + Cl2 → 2NaCl;
2. металу з кислотою: Zn + 2HCl → ZnCl2 + H2↑;
3. металу з розчином солі менш активного металу: Fe + CuSO4 → FeSO4 + Cu;
4. основного оксиду з кислотним оксидом: MgO + CO2 → MgCO3;
5. основного оксиду з кислотою: CuO + H2SO4 –t°→ CuSO4 + H2O;
6. основи з кислотним оксидом: Ba(OH)2 + CO2 → BaCO3↓ + H2O;
7. основи з кислотою: Ca(OH)2 + 2HCl → CaCl2 + 2H2O;
8. солі з кислотою: MgCO3 + 2HCl → MgCl2 + H2O + CO2↑;
9. розчину основи з розчином солі: Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓;
10. розчинів двох солей: 3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
Хімічні властивості
1. Термічне розкладання: CaCO3 → CaO + CO2↑ 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
2. Обмінні реакції з кислотами, основами й іншими солями:
AgNO3 + HCl → AgCl↓ + HNO3 Fe(NO3)3 + 3NaOH → Fe(OH)3↓ + 3NaNO3
3. Окисно-відновні реакції, обумовлені властивостями катіона чи аніона.
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Кислі солі (гідрогенсолі) утворюються внаслідок неповного заміщення атомів Гідрогену багатоосновних кислот на атоми металу, наприклад, NaHCO3, KH2PO4, KНSO4. При дисоціації дають катіони металу (NH4+), йони Гідрогену та аніони кислотного залишку:
NaHCO3 ⇄ Na+ + HCO3– ⇄ Na+ + H+ + CO32–; KH2PO4 ⇄ K+ + H2PO4–.
Одержання
1. Взаємодія кислоти з недостачею основи: KOH + H2SO4 → KHSO4 + H2O
2. Взаємодія основи з надлишком кислотного оксиду: Ca(OH)2 + 2CO2 → Ca(HCO3)2
3. Взаємодія середньої солі з кислотою: Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Хімічні властивості
1. Термічне розкладання з утворенням середньої солі: Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
2. Взаємодія з лугом, одержання середньої солі: Ba(HCO3)2 + Ba(OH)2 → 2BaCO3↓ + 2H2O
Основні солі (гідроксосолі) утворюються внаслідок неповного заміщення гідроксогруп багатокислотних основ кислотними залишками, наприклад, Bi(OH)2Cl. До них належать і оксосолі, наприклад, BiOCl, утворені дегідратацією гідроксосолей. При дисоціації дають катіони металу, гідроксид-йони та аніони кислотного залишку:
Приклади дисоціації основних солей: MgOHCl ⇄ MgOH+ + Cl–; AlOHSO4 ⇄ AlOH2+ + SO42–.
Одержання
1. Гідроліз солей, утворених слабкою основою і сильною кислотою: ZnCl2+H2O→[Zn(OH)]Cl+HCl
2. Додавання (по краплях) невеликих кількостей лугів до розчинів середніх солей металів:
AlCl3 + 2NaOH → [Al(OH)2]Cl + 2NaCl
3. Взаємодія солей слабких кислот із середніми солями
2MgCl2 + 2Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2 + 4NaCl
Хімічні властивості
1. Термічне розкладання: [Cu(OH)]2CO3(малахіт) ® 2Cu + CO2↑ + H2O
2. Взаємодія з кислотою з утворенням середньої солі: Sn(OH)Cl + HCl = SnCl2 + H2O
Комплексні. Містять складні катіони чи аніони: [Ag(NH3)2]Br ⇄ [Ag(NH3)2]+ + Br –
Маючи основні поняття про класи неорганічних сполук, студент повинен уміти зображати їх графічні формули, складати рівняння реакцій, що можуть проходити між сполуками, знати способи одержання тих чи інших сполук та методи перетворення одних речовин в інші.
Контрольні питання та вправи
1. Складіть рівняння реакцій між:
1) магній оксидом і сульфур (VI) оксидом; 2) алюміній оксидом і сульфатною кислотою;
3) цинк гідроксидом і натрій гідроксидом; 4) цинком і хлоридною кислотою;
5) карбон (ІV) оксидом і барій оксидом; 6) сульфур (IV) оксидом і натрій гідроксидом;
7) хром (VI) оксидом і літій оксидом; 8) ферум (ІІІ) гідроксидом і нітратною кислотою;
9) купрум (II) сульфатом і цинком; 10) кальцій оксидом і сульфур (IV) оксидом;
11) алюміній оксидом і натрій гідроксидом; 12) розведеною нітратною кислотою і міддю;
13) натрій хлоридом і аргентум нітратом; 14) фосфор(V) оксидом і кальцій оксидом;
15) алюміній оксидом і хлоридною кислотою; 16) магнієм і хлоридною кислотою.
Вкажіть тип реакції.
2. Які солі можуть утворитися при взаємодії:
| 1. Ca(OH)2 + H3PO4 = | 5. Al(OH)3 + H2SO4 = | 9. NH4OH + H3PO4 = | 13. NH4OH + H2SO4 = |
| 2. NaOH + H2CO3 = | 6. Bа(NO3)2+ Na2SO4 = | 10. Cr(OH)2 + HNO3 = | 14. Ва(OH)2 + H3РO4 = |
| 3. Bі(OH)3 + H2SO4 = | 7. SO2 + NaOH = | 11. Nі(OH)2 + HCl = | 15. SnO + HCl = |
| 4. Sn(OH)2 + HCl = | 8. NaOН + H2CO3 = | 12. Zn(OH)2 + H2SO4 = | 16. КОН + Сu(SO4) = |
3. Складіть рівняння одержання середніх солей із кислих і основних:
| 1. MgOHCl | 5. Al(OH)Cl2 | 9. SbOHBr | 13. FeOHSO4 |
| 2. KHS | 6. Fe(HSO3)2 | 10. CaH2P2O7 | 14. Zn(HCO3)2 |
| 3. Bі(OH)2NO3 | 7. CrOHSO4 | 11. Sn(OH)Cl | 15. (SnOH)2SO4 |
| 4. Na2HPO4 | 8. Fe(H2PO4)3 | 12. CaHPO4 | 16. Cu(HCO3)2 |
5. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
1) Ca ® Ca(OH)2 ® CaCO3 ® Ca(HCO3)2 ® CaCO3 ® CaO;
2) Al ® Al2O3 ® AlCl3 ® Al(OH)3® Al2(SO4)3
3) Cu ® Cu(NO3)2 ® Cu(OH)2 ® CuO ® CuSO4 ® CuS
4) Zn ® ZnO ® Zn(NO3)2 ® Zn(OH)2 ® Zn(OH)NO3 ® Zn(NO3)2
5) K ® KOH ® Cr(OH)3 ® Cr2O3 ® Cr2(SO4)3
6. Для наступних елементів написати формули оксидів та гідроксидів:
1) Са (ІІ), 2) В (ІІІ), 3) Аl (III), 4) Si (IV), 5) Sn (II), 6) N (V), 7) S (VI), 8) Mn (II), 9) Mg (II),
10) Cl (III), 11) Mn (VII), 12) C (IV), 3) Cl (VII), 14) P (V), 15) Cu (II), 16) Cr (III), 17) Pb (II),
18) S (IV).
7. Закінчіть наступні рівняння реакцій:
1) Ca(OH)2 + N2O5 ® 2) P2O5 + H2O ® 3) Zn + H2SO4 ®
4) MgCl2 + AgNO3 ® 5) Na2S + H2S ® 6) MgCO3 + CO2 + H2O ®
7) BaO + H2O ® 8) Mg + H2SO4 ® 9) Al(OH)Cl2 + HCl ®
10) Sn(OH)Cl + HCl ® 11) KOH + H2S ® 12) ВаCl2 + H3РO4 ®
13) SO2 + CuO ® 14) Fe(OH)3 ® H2O + 15) Na + H2O ®
16) Zn + CuCl2® 17) ZnCl2 + KOH ® 18) CaCO3 + H2SO4 ®
Будова атома






