МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ХЕРСОНСЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ
КАФЕДРА ФІЗИЧНОЇ ТА НЕОРГАНІЧНОЇ ХІМІЇ
Лабораторний журнал
З дисципліни
Ф І З И Ч Н А Х І М І Я
для студентів першого курсу
спеціальності 7.090804 „Фізична та біомедична електроніка”
МЕТОДИЧНІ ВКАЗІВКИ
ДО ВИКОНАННЯ І ОФОРМЛЕННЯ РОБІТ
Група_________________________________________________________________
П І Б__________________________________________________________________
ХЕРСОН 2005
Лабораторний журнал з дисципліни Фізична хімія для студентів першого курсу спеціальності 7.090804 „Фізична та біомедична електроніка” (методичні вказівки до виконання і оформлення робіт)/ В.М. Безпальченко, З.В. Друзяк, В.П. Єфімцев, О.О. Семенченко – Херсон, ХНТУ, 2005. – 45 с.
Рецензент: завідувач кафедри фізичної та біомедичної електроніки Херсонського національного технічного університету, доктор хімічних наук професор Новіков О.О.
Затверджено та рекомендовано до друку на засіданні кафедри фізичної та неорганічної хімії Херсонського національного технічного університету (протокол № 1 від 29.08.2005 р.)
Завідувач кафедри: Г.В. Міщенко
В.М. Безпальченко, З.В. Друзяк,В.П. Єфімцев,О.О. Семенченко
© ХНТУ, 2005
Вступ
Лабораторний журнал розроблено для студентів першого курсу спеціальності 7.090804 Херсонського національного технічного університету. Він містить стислий виклад теорії з хімії, лабораторні роботи і завдання для самоконтролю, а також правила роботи в хімічній лабораторії.
До журналу увійшли лабораторні роботи з тем: "Термодинаміка", "Кінетика та хімічна рівновага", "Загальна характеристика розчинів. Електролітична дисоціація. Реакції в розчинах електролітів. Умови утворення осаду", "рН. Гідроліз солей", "Окисно-відновні реакції", "Гальванічні елементи", "Електроліз", „Визначення твердості води”. У лабораторних роботах стисло викладено теорію, наведено приклади реакцій, перелік основних матеріалів, реактивів і обладнання, докладний опис виконання роботи, розрахунків й очікуваних результатів. Така побудова дозволяє проводити лабораторні досліди без додаткових вказівок, що має важливе значення для підготовки студентів до самостійного виконання наукових робіт. По кожній лабораторній роботі чи досліду студент повинен зробити висновок, а саме чи побудувати графік, чи написати рівняння реакції, свої спостереження. Під час виконання запропонованих робіт студенти не тільки опановують сучасні методи експериментальних досліджень, але й набувають уміння аналізувати одержані результати.
Після кожної лабораторної роботи чи теоретичного розділу приведено контрольні питання і задачі, які спрямовують студентів для самостійного опанування матеріалу.
До журналу увійшли теоретичні теми: "Класи неорганічних сполук" та "Будова атома", які є базовими при вивченні курсу. Приведено основні хімічні поняття та основні хімічні закони.
Правила роботи в хімічній лабораторії
Виконання лабораторних робіт розраховано на одержання навичок експериментальної роботи. Перш ніж починати виконання якого-небудь експерименту, слід познайомитися з устаткуванням і приладами, застосовуваними при його виконанні, правилами роботи в хімічній лабораторії і технікою безпеки. Не починати здійснення досліду, поки не стане ясною мета його, поки не перевірено наявність устаткування, необхідного для досліду (посуд, прилади, реактиви).
При роботі точно зберігайте порядок і послідовність операцій проведення дослідів.
Важливо навчитися правильно обробляти отримані експериментальні дані й оцінювати помилки експерименту. Основним місцем виконання лабораторних робіт є робочий стіл, на якому мається визначений набір приналежностей. Працюйте завжди на тому самому місці, бажано в халаті. Під час проведення досліду на робочому місці не повинно бути нічого зайвого. Перш ніж приступити до роботи, ретельно вивчіть її по опису, підготуйте необхідні прилади і реактиви. Уважно спостерігайте за ходом досліду, відзначаючи і записуючи кожну його особливість (випадання і розчинення осадів, зміну забарвлення, температури і т.ін.).
Студенти, що пройшли інструктаж з техніки безпеки і розписалися в журналі, допускаються до роботи тільки в присутності викладача чи відповідального за лабораторію.
Користайтеся реактивами, приготовленими для даної лабораторної роботи. Роботи зі шкідливими речовинами виконуйте тільки під тягою при увімкненій витяжній системі. Забороняється досліджувати властивості речовин без дозволу викладача, а також пити воду з хімічного посуду. Не нюхайте гази, що виділяються, близько нахиляючись до посудини. При визначенні запаху газу чи рідини обережно вдихайте повітря, злегка направляючи рукою струм його від посудини до себе. При нагріванні пробірки не тримайте її отвором до себе чи убік товаришів.
Якщо випадково проллєте кислоту чи луг, то швидко змийте їх водою, а потім зверніться до лаборанта і за його вказівкою приведіть у належний порядок своє робоче місце. Не витрачайте реактивів більше необхідної кількості. Якщо ж випадково взяли розчину чи сухих препаратів більше, ніж необхідно, то надлишки викидайте (за вказівкою викладача чи лаборанта) у спеціальні сміттєзбірники, щоб уникнути забруднень реактиву. Не несіть прилади, апарати загального користування на своє робоче місце. Не плутайте пробки від краплинних піпеток і реактивних склянок. Не виливайте в раковину відпрацьовані концентровані кислоти і луги, а користайтеся для цього банками, установленими під тягою. Папір і залишки твердих речовин кидайте в урни. Відпрацьовані розчини солей срібла виливайте в спеціально відведений посуд, тому що при тривалому зберіганні аміачних розчинів солей срібла може утворитися вибухова речовина – гримуче срібло. Після закінчення роботи вимийте використаний посуд, виключіть воду й електрику, приведене в порядок робоче місце здайте лаборанту. Підсумки заняття запишіть за установленою формою в робочий журнал і щораз давайте на підпис викладачу. При нещасних випадках негайно заявляйте лаборанту і викладачу. У лабораторії є настінна аптечка з необхідним для екстреної допомоги.
Запам'ятайте!
1. При запаленні бензину, спирту, ефіру накрийте полум'я азбестом чи засипте піском.
2. У випадку загоряння одягу слід гасити полум'я обгортанням у ковдру чи ін. Ні в якому разі не бігти.
3. У випадку порізу склом переконайтеся, що в ранці немає осколків, і ватою, змоченою етиловим спиртом чи перманганатом калію, видаліть кров, змажте йодом і забинтуйте.
4. При термічних опіках (від вогню, пари, гарячих предметів чи електричної дуги) накладіть пов'язку (марля, бинт), змочену розчином з масовою часткою KMnО4 3 %, розчином з масовою часткою стрептоциду 2 % чи розчином харчової соди. Не можна змазувати опік вазеліном чи жиром. При опіках кислотами насухо витріть опік рушником, промийте великою кількістю води чи розчином з масовою часткою харчової соди 2 – 3 %, чи слабким розчином амоніаку. У випадку опіку плавиковою кислотою (HF) тривало промивайте постраждале місце водою (до появи почервоніння), а потім прикладіть суспензію з масовою часткою магній оксиду 20 % у гліцерині. При опіках лугами обмийте водою і нейтралізуйте лимонною кислотою чи розчином з масовою часткою оцтової кислоти 1 – 2 %.
Основні хімічні поняття
Атом – найменша хімічно неподільна електронейтральна частинка матерії, що складається з позитивно зарядженого ядра й негативно заряджених електронів і є носієм хімічних властивостей елемента. Молекула – найменша частинка речовини, яка має сталий склад і зберігає її хімічні властивості. Атомна (молекулярна) маса Ar (Mr) – значення маси атома (молекули), виражене в атомних одиницях маси. 1 атомна одиниця маси (а.о.м.) дорівнює 1/12 частини маси атома ізотопу Карбону 12С і становить 1,66 · 10–24 г. Молекулярна маса конкретної речовини дорівнює сумі мас атомів усіх елементів, що входять до складу молекули.
Елемент – тип атомів, що мають однакові хімічні властивості, однакове протонне число й певне середнє значення атомної маси.
Валентність – здатність атома утворювати хімічний зв'язок. За одиницю валентності приймають один хімічний зв'язок, що здатний утворити атом Гідрогену.
Ступінь окиснення – умовний заряд, що має елемент в йонній сполуці чи мав би в ковалентній сполуці, якби загальна електронна пара була б цілком зміщена до більш електронегативного елемента. Ступінь окиснення має цифрове вираження і відповідний знак заряду (+) чи (–). Наприклад, у H2SO4 ступінь окиснення Гідрогену +1, Оксигену –2, Сульфуру +6, а валентність, відповідно, 1, 2, 6.
Моль – кількість речовини, що містить 6,02 · 1023 структурних одиниць (атомів, молекул, йонів, електронів і т. ін.): 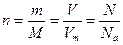 , моль.
, моль.
Маса 1 моль даної речовини називається її молярною масою: M =  , г/моль.
, г/моль.
Наприклад, молярна маса сульфатної кислоти М(Н2SO4) = 98 г/моль.
Еквівалент (Е) – масова кількість речовини, що взаємодіє з одним атомом чи йоном Гідрогену чи заміщає таку його кількість у хімічних реакціях. Еквівалент Гідрогену ЕН дорівнює одиниці. (ЕН = 1). Еквівалент Оксигену ЕО дорівнює восьми (ЕО = 8). Еквівалент елемента – величина змінна. Вона залежить від атомної маси (А) і валентності (В), що елемент має в конкретній сполуці. Е = А/В. Наприклад, визначимо еквівалент Сульфуру в оксидах SO2 і SO3. У SO2 ЕS = 32/4 = 8, а в SO3 ЕS = 32/6 = 5,33. Масу 1 моля еквівалентів речовини називають молярною масою еквівалентів речовини або еквівалентною масою (МЕ).
Молярні маси еквівалентів простих речовин розраховують за формулою:
МЕ =  , (г/моль). Наприклад: МЕ(Н2) = 1 г/моль, МЕ(О2) = 8 г/моль, МЕ(Сl2) = 35,5 г/моль.
, (г/моль). Наприклад: МЕ(Н2) = 1 г/моль, МЕ(О2) = 8 г/моль, МЕ(Сl2) = 35,5 г/моль.






