Определения и утверждения
Выберите правильное(ые) утверждение(я) или определение(я). Ваш выбор обоснуйте путем критики всех остальных утверждений или определений.
4.1. Скорость химической реакции — это
1) количество реагента, испытывающего превращение в единицу времени.
2) количество продукта, образующегося в единицу времени.
3) изменение концентрации одного из участников реакции в единицу времени.
4) изменение количества какого-либо участника реакции в единицу времени в единице реакционного пространства.
5) изменение количества какого-либо участника реакции в единицу времени в единице реакционного пространства, деленное на стехиометрический коэффициент перед формулой этого вещества в уравнении реакции.
4.2. Порядок химической реакции — это
1) то же, что молекулярность.
2) сумма стехиометрических коэффициентов.
3) сумма показателей степеней в кинетическом уравнении.
4) число частиц, принимающих участие в элементарном акте.
5) понятие, не имеющее физического смысла (а зачем вводится?)
4.3. Скорость химической реакции
1) увеличивается с увеличением концентраций реагентов (однако концентрированная уксусная кислота медленнее реагирует с цинком, чем 20%-ная!?).
2) увеличивается с увеличением площади соприкосновения веществ-реагентов.
3) не зависит от степени измельчения реагентов.
4) зависит от количеств веществ-реагентов.
5) не зависит от количеств веществ-реагентов.
4.4. Скорость химической реакции
1) уменьшается с повышением температуры, если реакция экзотермическая, и увеличивается в эндотермической реакции.
2) всегда увеличивается при повышении температуры.
3) всегда увеличивается при повышении температуры, но только в том случае, если реакция идет в одну стадию.
4) с повышением температуры иногда может уменьшаться.
Вопросы и задачи
4.5. В промышленном производстве необходимо, чтобы скорость реакции была
| 1) максимальна. | 2) минимальна. | 3) оптимальна. |
4.6. Ответьте на вопросы.
1. Что такое кинетическое уравнение?
2. В каком случае показатели степени при концентрациях реагентов в кинетическом уравнении равны стехиометрическим коэффициентам? Какова максимальная сумма величин степеней в этом случае?
3. В каких пределах заключена возможная величина порядка реакции?
4. В каких (двух) случаях порядок реакции по какому-либо реагенту может равняться 0?
5. Зависит ли скорость реакции от материала реактора, в котором она проводится? Ответ мотивируйте.
6. Зависит ли скорость реакции от концентрации катализатора? От его количества?
7. “Скорость любой химической реакции возрастает с повышением температуры.” Чего не хватает в этом определении, чтобы быть правильным?
8. В каком случае скорость одной и той же химической реакции сильнее зависит от температуры — в присутствие или отсутствие катализатора?
| С (NО), ммоль/л | 3,0 | 1,0 | 0,3 | 1,0 |
| С (O2), ммоль/л | 3,0 | 3,0 | 0,3 | 0,3 |
| r, 10-5 ммоль/л·с | 27,0 | 3,0 | 0,027 | 2,7 |
4.7. Составьте кинетическое уравнение реакции 2NО + O2 = 2NO2 по экспериментальным данным, полученным при некоторой температуре и приведенным в таблице. Вычислите константу скорости реакции.
| р (NO)исх, атм | 0,50 | 0,25 | 1,0 | 0,50 |
| p (Cl2)исх, атм | 0,50 | 0,25 | 1,0 | 1,0 |
| r нач, 10–2 атм/с | 0,51 | 0,06 | 4,0 | 1,0 |
4.8. Для реакции
2NOг + Cl2,г = 2NOClг
в четырех экспериментах получены данные, приведенные в таблице. Составьте кинетическое уравнение. Вычислите константу скорости реакции.
4.9. Вычислите энергию активации и коэффициент Ван-Гоффа и определите порядок реакции, если константы скорости реакции
1. N + O2 = NO + O
при 637 и 313°С равны соответственно 1,8·108 и 1,6·107 л·моль–1·с–1.
2. цис-бутен-2 ® транс-бутен-2
при 390 и 418°С равны соответственно 1,0·10–6 и 1,7·10–6 с–1.
3. пиролиза метана при 735 и 800°С равны 1,2·10-7 и 6,0·10-5 с-1, соответственно.
4. разложения оксида азота (V) 2N2O5 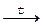 4NO + O2
4NO + O2
при 0 и 25°С равны соответственно 7,87·10-7 и 3,46·10-5 с-1.
5. 2NO + Сl2 = 2NOCl, если константы скорости этой реакции при температурах 0 и 30°С равны 2,6·10-7 и 6,0·10-5 л2·моль-2·с-1, соответственно.
6. гидрирования этилена, если константы скорости этой реакции при температурах 475 и 500°С равны 0,47·10-2 и 1,14·10-2 л/(моль·с), соответственно.
4.10. При 20°С скорость некоторой реакции равна 9,0 ммоль/(л·с), а при 0°С — 1,0 ммоль/(л·с). Вычислите скорость этой реакции при 100°С. Обсудите достоверность полученного результата.
4.11. Во сколько раз возросли скорости прямой и обратной реакций, если введенный в реакционную смесь катализатор понизил энергию активации прямой реакции с
1. 200 до 50 кДж/моль?
2. 20 до 5 кДж/моль?
4.12. Как изменится константа равновесия, а также константы скоростей прямой и обратной реакций (уменьшатся или увеличатся) в равновесной системе (а) при повышении температуры, (б) при понижении давления, (в) при замене катализатора
1. 2SO2 + O2 Û 2SO3 (при замене Fe2O3 на V2O5)?
2. N2 + 3H2 Û 2NH3 (при замене Fe на Fe + Al2O3)
4.13. Ответьте на следующие вопросы для нижеприведенных реакций: (1) Чему равна константа скорости реакции при комнатной температуре? (2) Укажите размерность константы скорости. (3) Вычислите ее скорость при комнатной температуре и концентрациях реагентов по 0,01 моль/л. (4) Какое влияние окажет повышение температуры на скорости прямой и обратной реакций? (5) Тот же вопрос для давления. (6) Тот же вопрос для катализатора. (7) Какое влияние окажут повышение температуры и давления на состояние равновесия в этой системе (если оно устанавливается)?
Известно, что скорость реакции
1. цис- ® транс- изомеризации бутена-2 при 390°С описывается уравнением 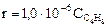 . Энергия активации этой реакции составляет 75 кДж/моль.
. Энергия активации этой реакции составляет 75 кДж/моль. 

2. цис- ® транс -изомеризации фенилнитрилэтилена при 352°С описывается уравнением 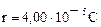 . Энергия активации этой реакции составляет 193 кДж/моль.
. Энергия активации этой реакции составляет 193 кДж/моль.
3. хлорметана со щелочью при 37,8°С описывается уравнением 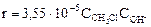 . Энергия активации этой реакции составляет 101,7 кДж/моль.
. Энергия активации этой реакции составляет 101,7 кДж/моль.
4. для реакции обмена лигандами Fe(H2O)63+ + Fe(D2O)62+ Û Fe(D2O)63+ + Fe(H2O)62+ энергия активации Е # = 46 кДж/моль, а константа скорости при 25°С k = 3,5 л·моль–1·с–1.
4.14. Рассмотрите следующие реакции и ответьте на вопрос, для какой(их) из них не выполняется правило Вант-Гоффа и почему?
1. 2H2O2 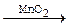 2H2O + O2
2H2O + O2
6P + 5KClO3  3P2O5 + 5KCl
3P2O5 + 5KCl
CH3(CH2) n CH3 + x O2 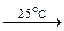 (n +2)CO2 + (n +3)H2O
(n +2)CO2 + (n +3)H2O
2CH4 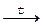 C2H2 + 3H2
C2H2 + 3H2
2. 2N2O5 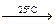 4NO + O2
4NO + O2
Zn + 2HCl = ZnCl2 + H2
CaSiO3 + CO2 = CaCO3 + SiO2
AgNO3 + HCl = AgCl¯ + HNO3
3. H2O2 + 2KI = 2KOH + I2
CaCO3 + SiO2 = CaSiO3 + CO2
2C2H2 + 5O2 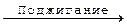 4CO2 + 2H2O
4CO2 + 2H2O
CH3Cl + NaOH = CH3OH + NaCl
4. HCl + NaOH = NaCl + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CH4 + 2O2 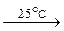 2H2O + CO2
2H2O + CO2
5. 2Ag + H2S = Ag2S + H2
CaO + 2H2O = Ca(OH)2
CH4 + 2O2 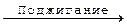 CO2 + 2H2O
CO2 + 2H2O
2NO + Сl2 = 2NOCl
6. BaCl2 + H2SO4 = BaSO4¯ + 2HCl
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
2H2 + O2 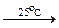 2H2O
2H2O
Fe(H2O)63+ + Fe(D2O)62+ Û Fe(D2O)63+ + Fe(H2O)62+
7. Zn + H2SO4 = ZnSO4 + H2
4Fe + 3O2 + 2 x H2O 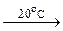 2Fe2O3· x H2O
2Fe2O3· x H2O
2H2 + O2 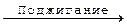 2H2O
2H2O
C3H4 + H2 = C2H6
Тема 5. Строение вещества
Атом
Определения и утверждения






