следуемой инактивированной сывороткой крови или плазмой. В лунку на пластине из плексигласа (или на обычное стекло) наносят 3 капли сыворотки и добавляют 1 каплю кардиолипинового антигена. Смесь тщательно перемешивают и учитывают результаты. Положительная реакция характеризуется образованием и выпадением хлопьев разной величины; при отрицательном результате наблюдается равномерная легкая опалесценция. Положительная реакция микропреципитации позволяет поставить предварительный диагноз и направить пациента на дальнейшее обследование.
Реакцию Вассермана ставят одновременно с двумя антигенами: 1) специфическим, содержащим антиген возбудителя — разрушенные ультразвуком трепонемы; 2) неспецифическим — кардиолипиновым. Исследуемую сыворотку разводят в соотношении 1:5 и ставят РСК по общепринятой методике. При положительной реакции наблюдается задержка гемолиза, при отрицательной — происходит гемолиз эритроцитов, интенсивность реакции оценивается соответственно от (++++) До (-)•
Первый период сифилиса является серонегативным и характеризуется отрицательной реакцией Вассермана. У 50 % больных реакция становится положительной не ранее чем через 2—3 нед после появления твердого шанкра. Во II и III периоде сифилиса частота положительных реакций достигает 75—90 %. После успешно проведенного курса лечения реакция Вассермана становится отрицательной.
Для диагностики поздних и латентных форм сифилиса можно ставить реакцию Вассермана, используя спинномозговую жидкость, с теми же антигенами, что и в реакции с сывороткой больного.
РИФ —реакция непрямой ИФ—является специфической при диагностике сифилиса. В качестве антигена используют взвесь тканевых трепонем. Разработаны разные методики постановки реакции; обычно используют модификацию РИФ-200. Сыворотку больного инактивируют так же, как для реакции Вассермана, и разводят в соотношении 1:200. На предметные стекла наносят каплю антигена, высушивают и фиксируют 5 мин в ацетоне. Затем на препарат наносят сыворотку больного, через 30 мин промывают и высушивают. Следующим этапом является обработка препарата флюоресцирующей сывороткой против иммуноглобулинов человека. Изучают препарат с помощью люминесцентного микроскопа, отмечая степень свечения трепонем.
Реакция иммобилизации трепонем также является специфической. Принцип реакции заключается в угнетении движения трепонем (иммобилизация) антителами сыворотки крови пациента в присутствии комплемента. Живую культуру
трепонем получают при культивировании в яичке кролика. Яичко зараженного животного измельчают в специальной среде, в которой трепонемы сохраняют подвижность. Ставят реакцию следующим образом: взвесь тканевых (подвижных) трепонем смешивают в пробирке с исследуемой сывороткой и добавляют свежий комплемент. В одну контрольную пробирку вместо исследуемой сыворотки добавляют сыворотку здорового человека, в другую — вместо свежего комплемента добавляют инактивированный. После инкубации при 35 "С в анаэробных условиях (анаэростат) из всех пробирок готовят препарат "раздавленная" капля и в темном поле определяют количество подвижных и неподвижных трепонем. Процент специфически иммобилизированных трепонем определяют по формуле:
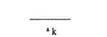
|
тх-т0
Х= хт °х100,
где Тк — число подвижных трепонем в контроле (с инактиви-рованным комплементом), Т0 — число подвижных трепонем в опыте (с активным комплементом). Результат реакции считают положительным, если процент иммобилизации выше 50, слабоположительным — от 31 до 50, сомнительным — от 21 до 30 и отрицательным — ниже 20. Для обнаружения специфических антител к T.pallidum используют и другие серологические реакции, в частности РНГА.
Необходимо отметить, что в широкой медицинской практике при обследовании больных и здоровых лиц обычно используют реакцию Вассермана и микропреципитации; РИТ, РИФ и другие специфические реакции применяют для уточнения диагноза и проводят в специализированных лабораториях.
• Микробиологическая диагностика мягкого шанкра
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: отделяемое из язвы (мягкого шанкра).
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Проводят путем микроскопии мазков, окрашенных по методу Грама и метиленовым синим. Наличие в мазках грамотрицательных бактерий, располагающихся в виде длинных цепочек, позволяет подозревать наличие возбудителя — Н. ducreyi.
Бактериологическое исследование. Проводят путем выделения чистой культуры возбудителя. Материал засевают на кровяной агар или другие среды, содержащие дефибринированную кровь. На этих средах H.ducreyi через 48—72 ч образует мелкие круглые колонии, окруженные зоной гемолиза. Идентификацию выделенной культуры проводят по ферментации Сахаров
 и по способности агглютинироваться сывороткой этого же больного.
и по способности агглютинироваться сывороткой этого же больного.
Кожно- аллергическая проба. Ставят с антигеном из Н.ducreyi для подтверждения диагноза.
• Диагностические, профилактические и лечебные препараты
Антигены для реакции Вассермана:
1) специфический антиген из тканевых трепонем, разрушенных ультразвуком;
2) неспецифический кардиолипиновый антиген — высоко-очищенный экстракт бычьего сердца, имеющий постоянный химический состав липидов, смешанных в определенной пропорции с лецитином и холестерином.
Антигены разводят согласно инструкции и используют в рабочих-дозах, указанных на этикетках. Кардиолипиновый антиген используют также и в реакции микропреципитации.
Антибиотики: пенициллин, цефотаксим, тетрациклины, эритромицин.
Тема 15.2. ВОЗБУДИТЕЛИ ГОНОРЕИ, УРОГЕНИТАЛЬНОГО ХЛАМИДИОЗА, МИКОПЛАЗМОЗА И УРЕАПЛАЗМОЗА
А План
▲ Программа
1. Биологические свойства возбудителей гонореи, уроге-нитального хламидиоза и уреаплазмоза; их патоген-ность, экология, особенности инфекции и эпидемиология вызываемых заболеваний.
2. Лабораторная диагностика.
3. Диагностические и лечебные препараты.
а Демонстрация
Neisseria gonorrhoeae — в мазках из чистой культуры и уретрального гноя, окраска по методу Грама.
2. Chlamydia trachomatis — в мазках со слизистой оболочки мочеиспускательного канала (иммунофлюоресцент-ный метод или окраска по методу Романовского— Гимзы).
3. "Пестрый" ряд для определения биохимических свойств N. gonorrhoeae.
4. Колонии Mycoplasma hominis на питательной среде (или фотографии этих колоний).
5. ИФА для серодиагностики урогенитальных инфекций, вызванных хламидиями и микоплазмами.
6. Диагностические и лечебные препараты.
А Задание студентам
1. Указать материал для исследования.
2. Микроскопировать и зарисовать мазок из уретрального гноя, окрашенный по методу Грама, сделать заключение.
3. Зарисовать демонстрируемый мазок со слизистой оболочки мочеиспускательного канала. Сделать заключение.
4. Оценить результаты ИФА при урогенитальных инфекциях, вызванных хламидиями и микоплазмами. Сделать заключение.
5. Дать краткую характеристику демонстрируемым диагностическим и лечебным препаратам.
А Методические указания
• Микробиологическая диагностика гонореи
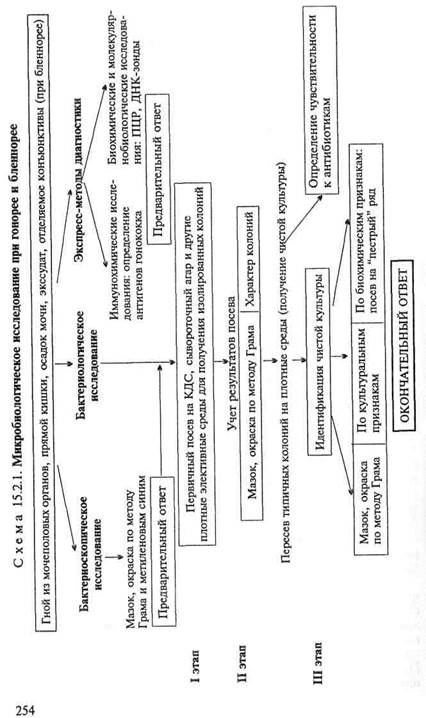
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гнойное отделяемое, мазки со слизистых оболочек мочеполовых органов и прямой кишки, суставной и перитонеальный экссудат, отделяемое конъюнктивы глаза при бленнорее.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Материал для исследования должен быть максимально быстро доставлен в лабораторию во избежание аутолиза гонококков, которые очень чувствительны к изменению температуры и охлаждению. Из материала готовят мазки, окрашивают их по методу Грама, а также метиленовым синим (схема 15.2.1). При положительном результате в мазках обнаруживают грамотрицательные диплококки бобовидной формы, находящиеся внутри лейкоцитов (рис. 15.2.1; на вклейке). Положительный бактериоскопический диагноз ставится в основном при острой форме гонореи до применения антибиотиков. При хронической гонорее бактериоскопическое исследование часто дает отрицательный результат, так как в этих случаях возбудители могут иметь атипичную форму в виде шаров или, наоборот, очень мелких образований. Кроме того, в препарате обнаруживают разнообразную постороннюю микрофлору, лейкоциты, эпителиальные и другие клеточные элементы.
Бактериологическое исследование. Материал засевают на чашки Петри со специальными питательными средами — КДС, сывороточным агаром и др. Среда КДС содержит питательный агар с добавлением казеина, дрожжевого экстракта и сыворотки крови. Посевы инкубируют при 37 "С в атмосфере с повышенным содержанием С02 (не менее 3 %) в течение 24—72 ч. Гонококки образуют круглые прозрачные колонии, напоминающие капли росы в отличие от более мутных колоний стреп-

|
тококков или пигментированных колоний стафилококков, которые также могут расти на этих средах. Подозрительные колонии пересевают в пробирки на соответствующие среды для получения чистых культур, которые идентифицируют по саха-ролитическим свойствам на средах "пестрого" ряда (полужидкий агар с сывороткой и углеводом) или с помощью микротест-систем. Гонококки ферментируют только глюкозу с образованием кислоты.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Антигены возбудителя могут быть обнаружены в исследуемом материале с помощью чувствительных иммунологических методов (иммуноблотинг и
ДР-)-
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. ДНК возбудителя в материале может быть обнаружена также методом гибридизации со специфическим ДНК-зондом.
• Микробиологическая диагностика урогенитального хлами-диоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: мазки со слизистой оболочки мочеиспускательного канала, выделения из шейки матки, соскобы, отпечатки и др.
МЕТОДЫ ДИАГНОСТИКИ:
Цитологическое исследование. Препараты, содержащие клетки, окрашивают по методу Романовского—Гимзы. В положительном случае в клетках эпителия обнаруживают цитоплазма-тические включения — микроколонии возбудителя, которые могут содержать как ретикулярные (сетчатые) тельца, так и элементарные тельца. Внеклеточные элементарные тельца таким способом не выявляются. Микроскопия окрашенных препаратов имеет ориентировочное значение.
Бактериологическое исследование. Чистую культуру хлами-дий из исследуемого материала выделяют путем заражения культур клеток McCoy, HeLa и других линий. После инкубации в течение 48 ч определяют включения возбудителя в клетках иммунофлюоресцентным методом. Выделение хламидий в культуре клеток имеет важное диагностическое значение, позволяет выявить жизнеспособные хламидий и определить их чувствительность к антимикробным препаратам.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Метод ИФ позволяет обна-
 |
| Глава 16 |
ружить антигены хламидий в зараженных клетках. Препараты из исследуемого материала обрабатывают мечеными МКАТ. В люминесцентном микроскопе хорошо видны ярко-зеленые скопления элементарных и ретикулярных телец (внутриклеточные микроколонии), контрастно выделяющиеся на красновато-коричневом фоне эпителиальных клеток.
Антигены возбудителя в исследуемом материале могут быть выявлены с помощью чувствительных серологических реакций (ИФА и др.).
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Основана на определении антител к хла-мидиям в сыворотке крови методами ИФА, РСК, РИГА. В качестве антигенов используют родоспецифические антигены (ЛПС), полученные из хламидий, диагностический титр 1:64. ИФА применяют так же, как дополнительный серологический метод при дифференциальной диагностике урогенитальных инфекций, вызванных хламидиями и микоплазмами.






