Антибиотикотерапия и химиотерапия. Антибиотики подавляют жизнедеятельность бактерий, риккетсий, микоплазм, простейших, слабее действуют на хламидий и грибы, не действуют на вирусы.
Современная классификация антибактериальных средств предусматривает их характеристику по происхождению, химической структуре, по типу действия на клетки бактерий, по спектру антимикробного действия и по механизму этого действия.
По происхождению антибактериальные средства делятся на две группы: антибиотики и химиотерапевтические препараты. К первым относятся препараты природного происхождения, продуцируемые микроорганизмами (или их химические производные). Ко вторым — антимикробные и антипаразитарные химические вещества (химический синтез).
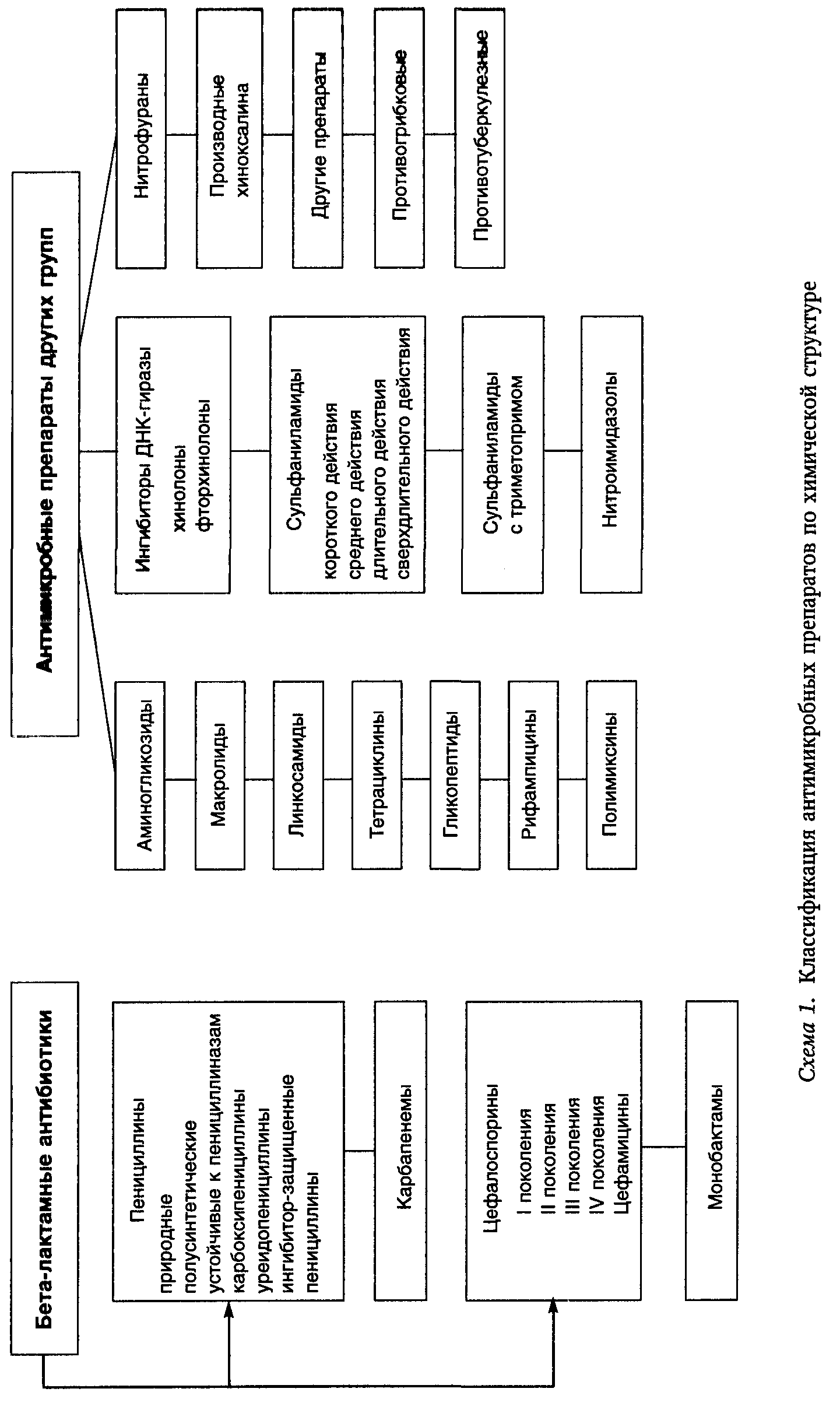
По своей химической структуре антимикробные препараты подразделяются на несколько групп: β-лактамные антибиотики (пенициллины, карбапенемы, цефалоспорины, монобактамы), другие антибиотики (аминогликозиды, макролиды, линкосамиды, тетрациклины, гликопептиды, рифампицины, полимиксины) и антимикробные препараты других групп (ингибиторы ДНК-гиразы: хинолоны и фторхинолоны; сульфаниламиды, в том числе в сочетании с триметопримом; нитроимидазолы; нитрофураны; производные хиноксалинов; противогрибковые, противотуберкулезные и другие препараты) (схема 1).
По типу действия на клетку различают бактерицидные (пенициллины, цефалоспорины, аминогликозиды), бактериостатические (тетрациклины, хлорамфеникол), препараты, обладающие либо бактерицидным, либо бактериостатическим действием в зависимости от вида микроорганизма и концентрации антибиотика (макролиды, линкосамиды, гликопептиды).
По спектру антимикробного действия выделяют препараты узкого (только на грамположительные бактерии и кокки — пенициллины и др., или только на грамотрицательные бактерии — азтреонам, полимиксин) и широкого (как на грамположительные, так и на грамотрицательные бактерии — аминогликозиды, тетрациклины, карбапенемы), а также противогрибковые антибиотики (нистатин, амфотерицин В, дифлюкан).
Механизм действия может быть различным. Во-первых, это ингибиция синтеза клеточной стенки микроорганизма (пенициллин, цефалоспорины, тей-копланин и др.). Во-вторых, это нарушение молекулярной организации и функции клеточных мембран (полимиксин, нистатин, леворин и др.). Наконец, это подавление синтеза белка и нуклеиновых кислот, в частности ингибиция синтеза белка на уровне рибосомы (хлорамфеникол, тетрациклины, макролиды, линкомицин, аминогликозиды) и ингибиция РНК-полимеразы (рифампицин и др.).
При лечении инфекционного больного следует назначать антибиотик, обладающий способностью действовать на возбудителя данного заболевания и условиях макроорганизма. Эффективность антибиотикотерапии зависит от точности этиологической диагностики заболевания, адекватности клинической диагностики нозологической формы и предварительного выделения возбудителя болезни с определением его чувствительности к антибиотикам. Важен выбор наиболее активного и, в то же время, обладающего наименьшими нежелательными реакциями для конкретного больного препарата. Желательно определить оптимальную дозу антибиотика и метод его введения для создания постоянной концентрации в очаге инфекции, превышающей минимальную подавляющую концентрацию (МПК) для данного микроба. Так, для создания достаточной концентрации пенициллина в тканях миндалин при лечении больных стрептококковым фаринготонзиллитом (ангиной) можно назначать пенициллин по 300 000 ЕД через 6 ч, а для лечения менингококкового менингита применяют от 12 до 24 млн ЕД в сутки, так как меньшие дозы не обеспечивают бактерицидной концентрации пенициллина в спинномозговой жидкости.
На терапевтическую эффективность антибактериальных препаратов существенно влияет развивающаяся к ним резистентность возбудителей. Как правило, через некоторое время после введения в практику того или иного антибиотика наряду с чувствительными штаммами возбудителя все чаще и чаще начинают встречаться штаммы, резистентные к данному препарату. Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам: модификация мишени действия антибактериальных препаратов; инактивация антибактериальных препаратов; активное выведение антибактериальных препаратов из микробной клетки (эффлюкс); нарушение проницаемости внешних структур микробной клетки и формирование метаболического «шунта».
Способствуют распространению устойчивых штаммов микроорганизмов следующие факторы: широкое бесконтрольное использование антибиотиков, часто без достаточных к тому оснований; применение малых дозировок препаратов; кратковременность курсов антибиотикотерапии; свободная продажа антибиотиков населению без рецептов врача, что создает возможность для самолечения.
Основным показанием к антибактериальной терапии инфекционного больного является присутствие в организме такого бактериального возбудителя, с которым организм сам не в силах справиться или при котором возможны значительные осложнения. При этом главное и решающее в выборе антибактериального средства — это возбудитель и его чувствительность к избранному препарату.
В то же время, при антибактериальной терапии нельзя переоценивать результаты изучения чувствительности микробов к препаратам. Например, брюшнотифозные микробы могут быть высокочувствительны к хлорамфениколу, но даже массивные дозы этого препарата не приводят к прекращению хронического бактериовыделения. Напротив, при тяжелых формах болезни у ослабленных больных знание чувствительности микробов к антибиотикам может играть решающую роль в выборе эффективной терапии.
Применение антибиотика должно начинаться как можно раньше. Это дает лучший терапевтический эффект и предотвращает тяжелые поражения органов и систем. В этой связи в большинстве случаев начальную антибактериальную терапию проводят эмпирически. Однако до назначения антибактериального препарата обязателен отбор материала (кровь, спинномозговая жидкость, отделяемое из миндалин и т. п.) для бактериологического исследования. Эмпирическое назначение антибиотиков основывается на знании природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также на результатах контролируемых клинических исследований.
Больным в тяжелом состоянии антибактериальная терапия назначается неотложно, при неуточненной этиологии используются препараты с широким спектром действия, в некоторых случаях — комбинация препаратов. Больным с иммунодефицитом — предпочтительнее препараты бактерицидного действия: беталактамы, аминогликозиды, ванкомицин, фторхинолоны и др.
Показанием к комбинированной антибиотикотерапии являются смешанные инфекции, а также недостаточная чувствительность возбудителя к моноантибиотикам и необходимость усиления антибактериального эффекта. В ряде случаев комбинация 2—3 антибиотиков позволяет предупредить развитие устойчивости микроорганизмов.
Следует помнить, что возможны различные варианты взаимодействия антибиотиков при их сочетанном применении: индифферентное — изменения эффекта каждого из противомикробных средств не отмечается (левомицетин + эритромицин). Аддитивное действие (суммация) - антибактериальный эффект применяемых препаратов равен сумме действия каждого из них в отдельности, независимо один от другого (ампициллин + оксациллин). Синергидное действие — эффект совместного применения двух антибиотиков превышает простую суммацию действия каждого препарата в отдельности (беталактамы + аминогликозиды). Антагонистическое действие — эффект, достигаемый при сочетании нескольких препаратов, ниже, чем эффект каждого в отдельности (беталактамы + тетрациклины).
Взаимодействие антибиотиков с патогенетическими средствами при одно-временном их применении также может в конечном итоге оказывать как положительный, так и отрицательный результат. Так, например, профессором кафедры инфекционных болезней ВМедА К. С. Ивановым доказано, что назначение эуфиллина, кофеина улучшает проникновение пенициллина через гематоэнцефалический барьер при лечении гнойных менингитов. Наоборот, длительное применение глюкокортикоидов ухудшает проницаемость этого барьера для данного антибиотика. Нежелательные эффекты взаимодействия антибактериальных препаратов и других лекарственных средств представлены в таблице 1.
Метод или путь введения в организм больного антибиотика определяется его биодоступностью (биоусвояемостью), под которой понимается часть препарата, которая после приема внутрь попадает в системный кровоток в активной форме. Антибактериальные препараты с биодоступностью более 60% (левомицетин, доксициклин, аминопенициллины, рифампицины, фторхинолоны и др.) должны по возможности назначаться внутрь (per os). Антибактериальные препараты с биодоступностью 30—60% более эффективны при парентеральном введении (оксациллин, клоксациллин, ампициллин, линкосамиды). Препараты с биодоступностью менее 30% (аминогликозиды, уреидопенициллины, инъекционные формы цефалоспоринов, карбапенемы, азтреонам и др.) применяются парентерально. При приеме внутрь они дают лишь местный эффект (ванкомицин при псевдомембранозном колите).
Таблица 1
Нежелательные эффекты взаимодействия антибактериальных препаратов и других лекарственных средств (по С. В. Яковлеву)
| Антибактериальные средства (А) | Другие средства (Б) | Эффект | ||
| Ампициллин, амоксициллин | Непрямые антикоагулянты | Усиление эффекта Б | ||
| Аминогликозиды | Петлевые диуретики (фуросемид) | Усиление ототоксичности А и Б | ||
| НПВС | Усиление ототоксичности А | |||
| Доксициклин | Фенобарбитал | Ослабление эффекта А | ||
| Доксициклин, тетрациклин | Соли магния, алюминия, висмута и железа | Снижение всасывания А | ||
| Тетрациклин | Соли кальция, цинка | Снижение всасывания А | ||
| Дигоксин | Увеличение токсичности Б | |||
| Инсулин | Усиление эффекта Б | |||
| Ко-тримоксазол | Непрямые антикоагулянты | Усиление эффекта Б | ||
| Гипогликемические ср-ва | Гипогликемия | |||
| Эритромицин, клиндамицин, линкомицин | Теофиллин | Увеличение концентраций Б, судороги | ||
| Эритромицин | Карбамазепин | Увеличение концентраций Б, нистагм, атаксия | ||
| Нитрофураны | Антациды | Снижение всасывания А | ||
| Сульфаниламиды | Ингибиторы МАО | Усиление токсических эффектов А | ||
| Непрямые антикоагулянты | Кровоточивость | |||
| Гипогликемические средства | Гипогликемия | |||
| Ципрофлоксацин, офлокса цин, пефлоксацин, норф-локсацин | Антациды, сукральфат | Снижение всасывания А | ||
| Ципрофлоксацин, пефлоксацин, эноксацин | Теофиллин | Увеличение концентраций Б | ||
| Левомицетин | Соли железа, витамин В12 | Снижение эффективности Б | ||
| Гипогликемические ср-ва | Гипогликемия | |||
Режим дозирования антибиотиков может быть различным. Для тех из них, активность которых зависит главным образом от их концентрации (concentration dependent killing drugs), таких как аминогликозиды, он заключается в создании возможно больших пиков концентрации препарата в крови, близких к токсическим. Рекомендуется однократное введение всей суточной дозы ами-ногликозидов, как правило, внутривенно капельно.
При использовании антибиотиков групп беталактамов, макролидов и линкозамидов, активность которых, в основном, зависит от длительности сохранения концентрации (time dependent killing drugs), необходимо поддерживать постоянную концентрацию этих препаратов в крови выше уровня МПК между их введениями. Частота введения определяет время сохранения необходимой концентрации препарата в крови после однократного введения.
Лечебный эффект от применения бактерицидных антибактериальных препаратов наступает через 1—2 дня, бактериостатических — через 3—4 дня. В эти сроки производится предварительная оценка клинического эффекта антибактериальной терапии. В целом, ее продолжительность зависит от клинического течения, нозологической формы. При циклических нерецидивирующих инфекциях антибактериальный препарат можно отменить через 1—2 дня после получения клинического эффекта. При циклических, но рецидивирующих болезнях (брюшной тиф, псевдотуберкулез) антибактериальное лечение продолжается столько времени, сколько болезнь продолжалась бы без этиотропной терапии. При циклических инфекциях, к числу которых относится сепсис, а также большинство заболеваний, вызванных условно-патогенной флорой, антибактериальные препараты назначаются в течение эмпирически установленных сроков с учетом клинического выздоровления.
При лечении антибактериальными препаратами необходимо иметь в виду вторичную резистентность микроорганизмов. К беталактамам, тетрациклинам, линкосамидам, левомицетину, ванкомицину, фосфомицину, фторхинолонам, нитрофуранам, нитроимидазолам вторичная устойчивость развивается медленно («пенициллиновый» вид резистентности). К аминогликозидам, макролидам, рифампицинам, фузидину, производным 8-оксихинолина и хинолонам I—II поколения вторичная резистентность развивается быстро («стрептомициновый» вид резистентности). Поэтому эти препараты следует назначать курсами не более 5—7 дней или комбинировать с другими антибактериальными средствами.
Выбор антибактериальных средств для лечения больных, находящихся в тяжелом, критическом состоянии, предполагает не столько увеличение их доз, сколько учет всех факторов патогенеза состояния, влияющих на фармакокинетику и фармакодинамику используемых средств, их возможные отрицательные эффекты в условиях острого нарушения функций жизненно важных органов и систем. Учитывая, что раннее применение антибиотиков в ряде случаев отрицательно влияет на иммуногенез, антибиотикотерапию в последние годы успешно сочетают с иммунотерапией.
Очевидно, что воздействовать на возбудителя можно не только антибиотиками, но и другими химиотерапевтическими препаратами. При протозойных заболеваниях (малярия, амебиаз, лейшманиоз, токсоплазмоз) эти препараты являются основными, а антибиотики играют вспомогательную роль. Количество химиотерапевтических препаратов, как и антибиотиков, нарастает с каждым годом, и сейчас они исчисляются многими десятками. К ним относятся различные противомалярийные препараты (хингамин или делагил, хиноцид, примахин, бигумаль, хлоридин), другие антипаразитарные средства (эметин и его производные, аминохинол, метронидазол, клион, фазижин, антигельминтные средства), сульфаниламидные, нитрофурановые и многие другие препараты. Все они изготавливаются синтетическим путем и по сравнению с антибиотиками обладают большей токсичностью. Общие принципы их применения аналогичны принципам антибактериальной терапии.
Противовирусные средства. Противовирусная терапия, в отличие от антибактериальной, обладает значительно меньшим арсеналом лечебных препаратов. По химическому составу и механизму действия противовирусные средства разделяются на три группы: 1) химиопрепараты; 2) интерфероны; 3) индукторы интерферонов.
К противовирусным химиопрепаратам относятся аномальные нуклеозиды (азидотимидин, ацикловир, рибавирин, идоксуридин и др.), производные адамантана (ремантадин, амантадин, адапромин и др.), синтетические аминокислоты (амбен, фоскарнет, аналоги пирофосфата и др.), производные тиосеми-карбазонов (марборан) и другие вирулицидные препараты (оксолин, теброфен, арбидол и др.). В большинстве своем эти препараты эффективны при лечении гриппа (ремантадин и др.), герпетической инфекции (ацикловир, ганцикловир и др.), натуральной оспы (марборан). В последние годы появились сведения об эффективности некоторых препаратов при вирусных гепатитах В и С (фамцикловир, ламивудин, зидовудин, диданозин, рибавирин), при ВИЧ-инфекции (азидотимидин, ретровир, тимозид, видекс, хивид, эпивир и др.). Эффективность терапии этих инфекций повышается при сочетании данных препаратов с ингибиторами протеазы (индинавир, саквинавир, нельфинавир, ритонавир).
Интерфероны (ИНФ) относятся к биологическим противовирусным неспецифическим средствам. Они представлены практически во всех клетках организма и направлены на подавление репликации вирусов, их элиминацию и санацию организма. Механизм противовирусного действия ИНФ связан с блокадой синтеза вирусоспецифических белков путем распознавания и дискриминации информационных РНК.
Препараты ИНФ делятся по составу на альфа-, бета- и гамма-интерфероны, а по способу получения - на природные человеческие, лейкоцитарные (первого поколения) и рекомбинантные (второго поколения). Для профилактики и лечения вирусных инфекций наибольший интерес представляют α-ИНФ. Они эффективны при вирусных гепатитах, герпетической инфекции, острых респираторных инфекциях и некоторых других вирусных заболеваниях. При вирусных гепатитах В и С нередко применяют комбинированную «двойную» или «тройную» терапию (α-ИНФ и 1-2 химиопрепарата из группы нуклеозидов).
Индукторы интерферона представляют собой весьма разнородную группу высоко- и низкомолекулярных природных и синтетических соединений, способных вызывать образование интерферона в организме больного. В настоящее время имеются данные о целесообразности использования в комплексной терапии низкомолекулярных синтетических соединений (флуорены, амиксин), природных полифенолов (кагоцел и др.), азотных оснований (камедон, циклофен, неовир) и некоторых полимеров (полудан, ларифан и др.). В частности, при вирусных гепатитах нашли применение такие индукторы интерферона, как амиксин и неовир (циклоферон).
Применение бактериофагов. Бактериофаги, или вирусы бактерий, обладают способностью разрушать (лизировать) бактерии. Однако их применение в клинической практике встречает определенные трудности. Это связано с наличием большого количества фаготипов одного и того же возбудителя, что требует подбора индивидуального фага. Кроме того, на введение фага организм отвечает выработкой антифаговых антител. Фаготерапия применяется преимущественно при острых кишечных инфекциях. В этих случаях бактериофаг вводят внутрь после предварительной нейтрализации желудочного сока. В последние годы бактериофаги, используемые для лечения, изготавливают со специальным покрытием, которое препятствует разрушительному действию желудочного сока. Имеются данные о высокой эффективности фаготерапии при ликвидации хронических очагов внутрибольничной инфекции (нозокомиальный сальмонеллез) в крупных многопрофильных стационарах (В. И. Покровский, В. Г. Акимкин).
Серотерапия. Воздействовать на возбудитель и его токсины возможно также путем использования иммунных сывороток (серотерапия). Начало их применения относится к концу XIX — началу XX века, когда после открытия возбудителей дифтерии и столбняка в медицинскую практику были введены, соответственно, противодифтерийная и противостолбнячная сыворотки.
Различают антитоксические и антибактериальные сыворотки. Антитоксические сыворотки содержат специфические антитела против токсинов — антитоксины и дозируются антитоксическими единицами. Действие их сводится к нейтрализации токсинов, вырабатываемых возбудителем. Антитоксическими сыворотками являются противодифтерийная, противостолбнячная, противогангренозная, противосибиреязвенная и др.
Антибактериальные сыворотки содержат антитела против бактерий (агглютинины, бактериолизины, опсонины). В последние годы антибактериальные сыворотки уступили место специфическим иммуноглобулинам, представляющим собой активную в иммунном отношении фракцию сыворотки. Их готовят из крови людей (гомологичные) или животных (гетерологичные). Эти препараты имеют высокую концентрацию антител, лишены балластных белков, являются малореактогенными. Гомологичные иммунные препараты обладают преимуществом перед гетерогенными в связи со сравнительно большой продолжительностью (до 1-2 мес.) их циркуляции в организме и отсутствием у них побочных эффектов. Сыворотки и иммуноглобулины, изготовленные из крови животных, действуют сравнительно недолго (1—2 нед.) и способны вызывать побочные реакции. Их можно применять только после предварительной десенсибилизации организма по Безредка, осуществляемой путем последовательного подкожного (с интервалом в 30—60 мин) введения небольших порций. Затем внутримышечно применяется вся доза лечебной сыворотки. При отдельных формах экзотоксических инфекций (токсическая дифтерия зева) 1/2—1/3 часть препарата при первом его введении можно применять внутривенно.
При положительной пробе на чувствительность к чужеродному белку гетерологичные препараты вводятся под наркозом или под прикрытием больших доз глюкокортикоидов. Введение гетерологичных сывороток во всех случаях проводят на фоне внутривенного введения кристаллоидных растворов. Это позволяет в случае развития осложнений (анафилактичекий шок) немедленно начинать неотложную помощь.
Общим принципом использования с лечебной целью готовых антител (сывороток или иммуноглобулинов) является необходимость возможно раннего применения препарата, пока возбудитель и токсины не проникли в органы и ткани, где они будут уже недоступны антителам. Доза препарата должна соответствовать клинической форме инфекционного процесса и быть способной нейтрализовать не только циркулирующие в данный момент в крови антигены возбудителей заболевания, но и те, которые могут появиться в ней в промежуток времени между введениями препарата. Малоэффективна серотерапия (специфическая пассивная иммунотерапия) при уже возникших осложнениях. Назначение ее после 4—5-го дня болезни редко дает выраженный положительный результат. Даже при раннем использовании сыворотки и иммуноглобулины, направленные против бактериальных возбудителей, обладают относительно меньшей эффективностью по сравнению с антибиотиками, и в последнее время их использование имеет подсобный характер. При вирусных болезнях применение пассивной иммунизации имеет больше оснований.
В настоящее время отечественная лечебная практика располагает средствами пассивной иммунизации против дифтерии (противодифтерийная антитоксическая гетерологичная сыворотка), ботулизма (противоботулиническая антитоксическая лошадиная очищенная и концентрированная сыворотка типов А, В, С, Е и F), поливалентный противоботулинический гомологичный гамма-глобулин против ботулотоксина типа А, В и Е), столбняка (противостолбнячная антитоксическая очищенная и концентрированная лошадиная сыворотка, а также человеческий противостолбнячный антитоксический гамма-глобулин),сибирской язвы (противосибиреязвенный антитоксический лошадиный иммуноглобулин), стафилококковой инфекции (противостафилококковый антитоксический человеческий иммуноглобулин, противостафилококковая донорская плазма, противостафилококковый гетерогенный антитоксический лошадиный иммуноглобулин), лептоспироза (противолептоспирозный гетерологичный воловий гамма-глобулин к пяти возбудителям: L. grippotyphosa, L. ротопа, L. ictero-haemorrhagie, L. canicola, L. tarasovi),, гриппа (противогриппозный донорский гамма-глобулин к вирусам гриппа типа А и В), клещевого энцефалита (проти-воэнцефалитный лошадиный гамма-глобулин или человеческий иммуноглобу лин). При ряде инфекций (полиомиелит, эпидемический паротит и др.) можно использовать нормальный человеческий иммуноглобулин, производимый из плацентарной, абортной и венозной крови людей. Существует также целый ряд зарубежных иммуноглобулинов (полиглобулин, пентаглобин, интраглобин, ци-тотект, гепатект и др.), используемых в основном при тяжелых бактериальных и вирусных инфекциях (вирусный гепатит, пересадка печени и др.).
Из возможных осложнений, наблюдающихся в основном при использовании гетерологичных сывороток и гамма-глобулинов, нужно отметить анафилактический шок, возникающий через несколько секунд (минут) после введения препарата, и позднее осложнение (через 7—12 сут.) — сывороточную болезнь. Реже могут возникать другие осложнения аллергического характера.
В целом, при использовании антибиотиков, химиопрепаратов и других средств воздействия на возбудителя и его токсины, возможен целый ряд осложнений. Наиболее часто встречаются аллергические, эндотоксические и дисбиотические осложнения.
Аллергические реакции (анафилактический шок и сывороточная болезнь) проявляются капилляротоксикозом, катаральными изменениями слизистых оболочек, дерматитом. Возможно поражение сердца (аллергический миокардит), легких (бронхит), печени (гепатит). Эндотоксические реакции возникают после введения массивных доз антибиотиков и связаны с усиленным распадом микробов и освобождением эндотоксина. Наконец, серьезной проблемой является дисбиоз, связанный с угнетением нормальной микрофлоры желудочно-кишечного тракта и избыточным размножением условно-патогенной и патогенной микрофлоры, включая стафилококки, некоторые грамотрицательные микробы и дрожжеподобные грибы рода Candida.
Эфферентная терапия. Для выведения из организма больного возбудителей и их токсинов в последние годы существенно расширились возможности использования различных методов эфферентной терапии инфекционных больных. Эфферентная терапия (от лат. efferens — выводить) направлена на выведение из организма токсических и балластных веществ (включая микробные токсины, бактерии и вирусы), метаболитов и осуществляется, главным образом, с помощью медико-технических систем. Одновременно возможно осуществление коррекции иммунологических нарушений (выведение избытка циркулирующих иммунных комплексов, аутоантител и др.), белкового и водно-электролитного состава крови. Эфферентная терапия реализуется инвазивными (экстракорпоральная гемокоррекция и фотомодификация крови) и неинвазив-ными (энтеросорбция) методами. Основными методиками гемокоррекции являются гемодиализ, гемосорбция, плазмаферез, плазмосорбция, лимфосорб-ция, перитонеальный диализ, ликворосорбция, гемоксигенация (как дополнение к другим операциям, в том числе с применением перфторуглеродов) и др.






