М Е Т О Д И Ч Н І В К А З І В К И
Для самостійної роботи до курсу «Хімія»
для студентів, що навчаються за навчальними планами бакалаврів
спеціальності 7.092501
денної та заочної форми навчання.
Затверджено радою спеціальності:
7.092501, протокол № ___
від “____”_________2013 р.
Одеса ОНАХТ 2013
Методичні вказівки для самостійної роботи до курсу «Хімія» для студентів, що навчаються за навчальним планом для бакалаврів спеціальності 7.092501 денної та заочної форми навчання / Укладачі: Вікуль С.І., Желтвай І. І., Кузнєцова І. О. Янченко К.А., під редакцією Бельтюкової С.В. – Одеса: 2013 – с.
Укладачі: С.І. Вікуль, к.т.н., доц.
І. І. Желтвай, к.х.н., доц.
І.О.Кузнєцова к.т.н., доц.
К. А. Янченко, асистент
.
Відповідальний за випуск зав. кафедри Х та БХП Бельтюкова С.В., д.х.н., проф.
Тема 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ
Питання для самоперевірки
1. Які основні положення атомно-молекулярного вчення?
2. Що означають поняття: елемент, атом, молекула, формульна одиниця, речовина?
3. Дайте визначення поняттям моль і мольна (молярна) маса.
4. Дайте визначення поняттю хімічного еквівалента речовини. Покажіть зв’язок між еквівалентом, атомною масою, молекулярною масою та валентністю.
5. Визначте поняття простої та складної речовини.
6. Сформулюйте закон збереження маси та енергії.
7. Сформулюйте закон сталості складу. Зазначте його обмежений характер і межі використання.
8. Сформулюйте закон кратних відношень. Наведіть приклади.
9. Сформулюйте закон об’ємних відношень Гей-Люссака. Наведіть приклади
10. У чому сутність закону еквівалентів?
11. Сформулюйте закон Авогадро та його наслідки. Що показує число Авогадро?
12. Напишіть рівняння Менделєєва – Клапейрона. Який фізичний зміст одиниці вимірювання універсальної газової сталої?
13. Що називається відносною густиною газу? Яка залежність між молекулярною масою газу та його густиною щодо водню, повітря?
14. Наведіть формули для визначення молекулярних мас газоподібних речовин.
15. Що називають відносною густиною одного газу за іншим? Наведіть приклади.
16. Яке рівняння використовують для приведення об’єму газу до нормальних умов? Які умови називають нормальними?
17. Дайте визначення поняттю парціальний тиск газу. Сформулюйте закон парціальних тисків.
Приклади розв’язання задач
Приклад 1. Який об’єм за нормальних умов займають: 5,5 г СО2?
Розв’язання. а) Із закону Авогадро випливає, що за однакових умов 1 моль будь-якого газу займає той самий об’єм. Цей об’єм називається молярним об’ємом газу і за нормальних умов дорівнює 22,4 л. Молярна маса СО2 дорівнює 44 г/моль. Отже, для кількості речовини (ν) справедливо
Звідки л.
Приклад 2. Який об’єм за нормальних умов займуть 4 × 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 × 104 Па?
Розв’язання. Для приведення об’єму газу до нормальних умов користуються загальною формулою, що поєднує закони Бойля-Маріота та Гей-Люсака: (pV)/T = (p0V0)/T0, звідки V0 = (pVT0)/(p0T), де T0 = 273 К; p0 = 101325 Па;
Т = 273 + 50 = 323 К. 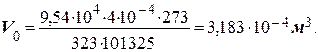
Приклад 3. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
Розв’язання. З умови задачі випливає, що в оксиді металу на 5 г металу припадає 9,44 – 5 = 4,44 г кисню. Відповідно до закону еквівалентів, маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
m1/m2 = E1/E2 (1.1)
Для умови нашої задачі цей закон виглядає наступним чином:
m (Me)/ m (O2) = E (Me)/ E (O2) (1.2)
Еквівалентну масу кисню визначають із співвідношення Е = А/w, де А – маса моля атомів елемента, а w – валентність елемента, звідси Е (O2) = 16/2 = 8 г/моль. Підставивши знайдені значення в (1.2), одержимо 5/4,44 = Е (Ме)/8. Звідки Е (Ме) = (5 × 8): 4,44 = 9,01 г/моль.
Приклад 4. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
Розв’язання. У даній задачі одна з реагуючих речовин знаходиться в газоподібному стані, а інша – у твердому. У цьому випадку закон еквівалентів записують у такий спосіб: V/Veq = m/E, де Veq – еквівалентний об’єм газоподібної речовини. Для умови нашої задачі закон виражається у такий спосіб:
V (Н2)/ Veq (Н2) = m (Ме)/ E (Ме) (1.3)
Еквівалентним об’ємом називають об’єм газоподібної речовини, що займає за даних умов один еквівалент цієї речовини. Молярний об’єм будь-якого газу за нормальних умов дорівнює 22,4 л. Звідси еквівалентний об’єм водню (молекула якого двоатомна) Veq (Н2) = 22,4: 2 = 11,2 л. Підставляючи дані задачі в (1.3) одержимо 1,4: 11,2 = m (Ме): 28, звідки m (Ме)=(1,4 · 28): 11,2 = 3,5 г.
Приклад 5. Обчислити еквівалентні маси H2SО4 і Аl(ОH)3 у реакціях, виражених рівняннями: Н2SО4 + КОН = КHSО4 + H2О (1.4)
H2SО4 + 2КОН = К2SО4 + 2H2О (1.5)
Аl(ОH)3 + НСl = Аl(ОH)2Сl + H2О (1.6)
Аl(ОH)3 + 3НNO3 = Аl(NО3)3 + 3H2О (1.7)






