Розв’язання. Електрони на останньому рівні та попередньому підрівні, якщо він незаповнений, - валентні.
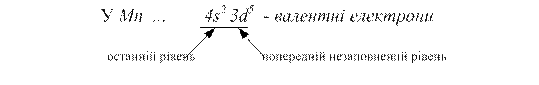
Приклад 4. Записати електронні формули атомівMn у збудженому стані та визначити їх максимальну валентність.
Розв’язання. Валентні електрони Mn...3d54s2 можна графічно відобразити
Mn0 + hʋ → Mn*
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | 
| ↑ | ||||||
| 3d | ↑↓ | 3d | ↑ | 4p | |||||||||||||
| 4s | 4s |
Звідси бачимо, що на 4s орбіталі маємо 2 спарених електрона. Якщо додати квант енергії, то їх можна розпарувати, тобто один з електронів перевести на більш високий підрівень. На слідуючому 4р підрівні маємо вільні енергетичні комірки. Туди після одержання додаткової енергії перейде один електрон з 4s-орбіталі і отримаємо збуджений стан атому Мn*
Mn0 …3d5 4s2 + hʋ → Mn* …3d5 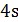 14p1
14p1
У збудженому стані атома зростає валентність. Вона визначається по кількості неспарених електронів. Для Мn * валентність дорівнює 7.
Збуджених станів може бути декілька. Це залежить від кількості пар спарених електроніз
Приклад 5. Записати електронні формули йонів з характерним ступенем окиснення для їх атомів.
Розв’язання. Йони утворюються коли атом приймає чи віддає електрони. Атом Мn не може прийняти електрони, бо зовнішній підрівень 4s у нього заповнений - на ньому 2 електрони. А попередній 3d підрівень, на якому 5 електронів не може приймати електрони, бо він закритий - «екранований» зовнішніми 4s - електронами. Тому атом Мn може тільки віддавати електрони. Електрони покидають зовнішні орбіталі, завжди їх повністю звільнюють
Mn0 – 2 ͞e̶ → Mn2+
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |||||
| 3d | ↑↓ | 3d | ||||||||||||
| 4s | 4s |
Mn0 …3d5 4s2 – 2 ͞e → Mn2+…3d5 4s0
Mn0 …3d5 4s2 – 3 ͞e → Mn3+…3d4 4s0
Mn0 …3d5 4s2 – 4 ͞e → Mn3+…3d3 4s0
Mn0 …3d5 4s2 – 5 ͞e → Mn3+…3d2 4s0
Mn0 …3d5 4s2 – 6 ͞e → Mn3+…3d1 4s0
Mn0 …3d5 4s2 – 7 ͞e → Mn3+…3d04s0
Звідси зрозуміло, що у Мn можуть бути 7 ступенів окиснення: Мn0, Мп+2, Мn+3,Мn+4,Мn+5, Мn+6, Мn+7.
Завдання для самостійної роботи
1. Записати електронні формули атомів.
2. Згідно правилам Клечковського підтвердити порядок заповнення енергетичних рівнів та підрівнів.
3. Визначити валентні електрони елементів.
4. Записати електронні формули атомів у збудженому стані та визначити їх валентність.
5. Записати електронні формули йонів з характерним ступенем окиснення для їх атомів.
| Варіант | Елементи | Варіант | Елементи |
| Si та Y | In та Se | ||
| Cl та Sc | Ge та O | ||
| Zn та S | As та Cd | ||
| Al та I | Ag та Ti | ||
| Cu та C | Ag та Mg | ||
| Sn та P | Au та Na | ||
| Tl та Ar | Ag та B | ||
| K та Zr | Sr та As | ||
| Pb та F | Cr та In |
ТЕМА 3. ПЕРІОДИЧНИЙ ЗАКОН Д.І. МЕНДЕЛЕЕВА
Питання для самоперевірки
1. Занотуйте формулювання періодичного закону Д.І. Менделєєва в сучасній редакції та редакції Д.І. Менделєєва.
2. Вкажіть фізичний зміст номеру періоду.?
3. Що таке група, чому вона поділяється на підгрупи?
4. Вкажіть фізичний вміст номера групи?
5. Який фізичний зміст порядкового номера елемента?
6. Як змінюються металеві та не металеві властивості елементів у групах?
7. Чим відрізняються елементи головних та побічних підгруп?
8. Де розміщуються валентні електрони у елементів головних та побічних підгруп? Що об'єднає елементи головних та побічних підгруп?






