Приклад 1. Чому дорівнюють питомі теплоємності cv і сp деякого двохатомного газу, якщо густина цього газу при нормальних умовах дорівнює 1,43 кг/м3?
Дано:
r = 1,43 кг/м3
i = 5
____________
cp –? cv –?
Розв’язування. Питомі теплоємності газів при сталому об’ємі і сталому тиску відповідно дорівнюють
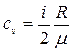 і
і 
З рівняння Клапейрона знаходимо молярну масу

оскільки густина газу  = m / V.
= m / V.
Підставляючи молярну масу у формули для теплоємності, одержуємо:
 і
і 
Виконаємо розрахунки, врахувавши, що для двохатомного газу число ступенів вільності i = 5. Тиск газу і температура при нормальних умовах відповідно дорівнюють p = 1,01.105 Па й T = 2730 K, тому:


Приклад 2. Кисень масою 2 кг займає об'єм 1 м3 і перебуває під тиском 0,2 МПа. Газ був нагрітий спочатку при постійному тиску до об'єму 3 м3, а потім при постійному об'ємі до тиску 0,5 МПа. Знайти зміну внутрішньої енергії газу, виконану ним роботу й теплоту, передану газу. Побудувати графік процесу.
Дано:
О2
m = 2 кг
V1 = 1 м3
p1 = 0,2 МПа = 2.105 Па
1) p = const, V2 = 3 м3
2) V = const, p3 = 0,5 МПа = 5.105 Па
DU –? A –? Q –?
Розв’язування. Зміна внутрішньої енергії газу
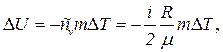 (1)
(1)
де i – число ступенів вільності молекул газу (для двохатомних молекул кисню i = 5);
DT = T3 - T1 – різниця температур газу в кінцевому (третьому) і початковому станах.
Початкову й кінцеву температуру газу знайдемо з рівняння Клапейрона

звідки
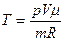 .
.
Робота розширення газу при постійному тиску виражається формулою
A1 =  .
.
Робота газу, який нагрівається при постійному об'ємі, дорівнює нулю
A2 = 0.
Отже, повна робота, виконана газом дорівнює,
A = A1 + A2 = A1.
Відповідно до першого принципу термодинаміки теплота Q1, передана газу, дорівнює сумі зміни внутрішньої енергії DU і роботи A
Q = DU + A.
Виконаємо обчислення, урахувавши, що для кисню m = 32 .10-3 кг/моль:



 Дж = 0,4 . 106 Дж = 0,4 МДж;
Дж = 0,4 . 106 Дж = 0,4 МДж;
A = A1 = 0,4 МДж;
 Дж = 3,24 . 106 Дж = 3,24 МДж;
Дж = 3,24 . 106 Дж = 3,24 МДж;
Q = (3,24 + 0,4) МДж = 3,64 МДж.
Графік процесу наведений на рис 2.
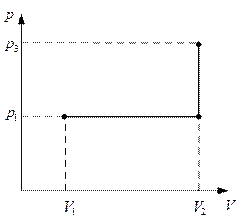
Рисунок 2
Приклад 3. У циліндрі під поршнем перебуває водень масою 0,02 кг при температурі 300К. Водень спочатку розширився адіабатно, збільшивши свій об'єм в 5 разів, а потім був стиснутий ізотермічно, причому об'єм газу зменшився в 5 разів. Знайти температуру наприкінці адіабатного розширення й роботу, виконану газом при цих процесах. Зобразити процес графічно.
Дано:
H2
m = 0,02 кг
T1 = 300 K
1) DQ = 0 V2/V1 = 5
2) DT = 0 V3/V2 = 1/5
________________
T3 –? A2 –? A3 –?
Розв’язування. Температури й об'єми газу, що виконує адіабатичний процес, зв'язані між собою співвідношенням
 або
або 
де g – відношення теплоємностей газу при постійному тиску й постійному об'ємі;
n1 = V2/V1 – відношення об’ємів газу в процесі.

Рисунок 3
Звідси одержуємо такий вираз для кінцевої температури
T2 = T1 / n1g -1.
Робота A1 газу при адіабатичному розширенні може бути визначена за формулою

де сV – питома теплоємність газу при постійному об'ємі.
Робота A2 газу при ізотермічному процесі може бути виражена у вигляді
 або
або 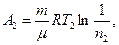

де n2 = V2/V3.
Виконаємо необхідні обчислення урахувавши, що для водню як двохатомного газу g = 1,4, i = 5 й m = 2 . 10-3 кг/моль

Оскільки 50,4 = 1,90 (знаходиться логарифмуванням), то



Знак мінус показує, що при стисненні робота газу виконується проти зовнішніх сил. Графік процесу зображений на рис. 3.
Приклад 4. Теплова машина працює за зворотним циклом Карно (рис. 4). Температура нагрівача 500K. Визначити термічний ККД циклу й температуру холодильника теплової машини, якщо за рахунок кожного кілоджоуля теплоти, отриманої від нагрівача, машина виконує корисну роботу в 350 Дж. Втрати теплової енергії на тертя не враховувати.
Дано:
T1 = 500K
Q1 = 1кДж .= 103 Дж
Aк = 350 Дж
_______________
h –? T2 –?

Рисунок 4
Розв’язування. Термічний ККД теплової машини показує, яка частина теплової енергії отримана від нагрівача, перетворюється в механічну роботу. Термічний коефіцієнт корисної дії виражається формулою
h = A / Q1,
де Q1 – теплота, отримана від нагрівача;
А – робота, виконана робочим тілом теплової машини.
Знаючи ККД циклу, можна за формулою h = (T1 - T2) / T1 визначити температуру холодильника T2
T2 = T1 (1 - h).
Виконаємо необхідні розрахунки:
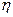 = 350 / 1000 = 0,35;
= 350 / 1000 = 0,35;
T2 = 500 (1 - 0,35) K = 325 K.
Приклад 5. Знайти зміну ентропії при перетворенні 10 г льоду взятого при температурі -20о С у пару при температурі 100о С.
Дано:
m = 10 г = 10-2кг
t1 = -20о C
t2 = 100о C
____________
 S –?
S –?
Розв’язування. Зміна ентропії визначається за допомогою формули
 (1)
(1)
де S1 і S2 – значення ентропії відповідно в першому й у другому стані.
У цьому випадку загальна зміна ентропії  S складається зі змін її в окремих процесах.
S складається зі змін її в окремих процесах.
1. Нагрівання маси m льоду від температури T1 до температури T2
dQ = mc1 dT,
де c1 – питома теплоємність льоду.
Таким чином, зміна ентропії в цьому процесі відповідно до формули (1) дорівнює
DS1 = mc1 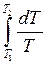 = mc1 ln(T2 / T1). (2)
= mc1 ln(T2 / T1). (2)
2. Плавлення маси m льоду при температурі T2. Тут
 , (3)
, (3)
де  – питома теплота плавлення.
– питома теплота плавлення.
3. Нагрівання маси m води від T2 до T3. Аналогічно за формулою (2), одержуємо
D S3 = mc2 ln(T3 / T2),
де с2 – питома теплоємність води.
4. Випаровування маси m води при температурі T3. Тут зміна ентропії буде дорівнювати

де r – питома теплота паротворення.
Загальна зміна ентропії дорівнює (закон зростання ентропії)
DS = DS1 + DS2 + DS3 + DS4 = m [c1 ln(T2 / T1) + l/T2 + c2 ln(T3/T2) + r/T3].
Виконавши необхідні обчислення, маючи на увазі, що c1=2,1.103 Дж / кг.К, T1 = 253K, T2 = 273K, T3 = 373K, l = 3,35.105 Дж / кг, с2 = 4,19.103 Дж / (кг.К), r = 2,26.106 Дж / кг, одержимо
 S = 88 Дж / К.
S = 88 Дж / К.
Приклад 6. Знайти зміну ентропії при переході 8 г кисню від об'єму в 10 л при температурі 80о С до об'єму в 40 л при температурі 300о С.
Дано:
m = 8 м = 8.10-3кг
V1 = 10 л = 10-2м3
t1 = 80о C
V2 = 40 л = 4.10-2м3
t2 = 300о C
_______________
 S –?
S –?
Розв’язування. Зміну ентропії для будь-якого процесу знаходять за формулою

Але
 ,
,
де  – теплоємність кисню при сталому об’ємі.
– теплоємність кисню при сталому об’ємі.
З урахуванням рівняння Клапейрона
 ,
,
маємо
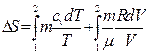
або
 .
.
Виконавши необхідні розрахунки одержуємо  S = 5,4 Дж/К.
S = 5,4 Дж/К.
Задачі
798. У балоні знаходиться m1 = 8 г водню і m2 = 12 г азоту при температурі t = 17о С і тиску p = 1,8·105 Па. Визначити молярну масу μ суміші й об’єм V балона.
Відповідь: μ = 4,51.10-3 кг/моль; V=0,06 м3.
799. Знайти тиск р суміші газу в посудині об’мом V = 5 л, якщо в ньому знаходиться N1 = 2·1015 молекул кисню, N2 = 8·1015 молекул азоту і m = 1,0 нкг аргону. Температура суміші t = 17оС.
Відповідь: р = 19,7.10-3 Па.
800. Один балон об’ємом 10 л містить кисень під тиском 1,5 МПа, інший балон об’ємом 22 л містить азот під тиском 0,6 МПа. Обидва балони були з'єднані між собою, і обидва гази змішалися, утворивши однорідну суміш (без зміни температури). Знайти парціальний тиск обох газів у суміші і повний тиск суміші.
Відповідь: pn1 = 0,47.106 Па; pn2 = 0,41.106 Па; p = 0,88.106 Па.
801. У посудині А об’ємом V1 = 2 л знаходиться газ під тиском p1 = 2·105 Па, а в посудині В об’ємом V2 = 4 л знаходиться той же газ під тиском p2 = 1·105 Па. Температура в обох посудинах однакова і постійна. Під яким тиском р буде знаходитися газ після з’єднання посудин А и В трубкою? Знайти парціальні тиски газів у суміші. Об’ємом з’єднувальної трубки знехтувати.
Відповідь: pn1 = 0,66.105 Па; pn2 = 0,66.105 Па; p = 1,33.105 Па.
802. У балоні об’ємом 22,4 л знаходиться водень при нормальних умовах. Після того, як у балон була додатково введена деяка кількість гелію, тиск у балоні зріс до 0,25 МПа, а температура не змінилася. Визначити масу гелію, введену додатково в балон.
Відповідь: m = 6.10-3 кг.
803. У балоні знаходиться 10 кг деякого газу під тиском 107 Па. Яку кількість газу взяли з балона, якщо остаточний тиск в балоні знизився до
2,5·106 Па? Температуру газу вважати постійною.
Відповідь: Δm = 7,5кг.
804. Суміш водню й азоту загальною масою 290 г при температурі 600 К і тиску 2,46 МПа займає об’єм 30 л. Визначити масу водню і масу азоту в суміші.
Відповідь: m1 = 9,5 г (Н2); m2 = 280,5 г (N2).
805. Два балони однакового об’єму містять кисень. В одному балоні тиск p1 = 2 МПа і температура T1 = 800 К, в іншому p2 = 2,5 МПа і T2 = 200 К. Балони з'єднали трубкою й охолодили кисень в них до температури Т = 200 К. Який тиск установиться в балонах?
Відповідь: p = 1,5 MПа.
806. У посудині знаходиться суміш кисню і водню. Маса суміші дорівнює 3,6 кг. Масова частка кисню складає 0,6. Визначити маси кожного газу в посудині.
Відповідь: m1 = 2,16кг (О2); m = 1,44 кг (Н2).
807. У колбі ємністю 100 см³ утримується деякий газ при температурі 300 К. На скільки знизиться тиск газу в колбі, якщо внаслідок витоку з колби вийде 1020 молекул цього газу?
Відповідь:  .
.
808. Знайти середню кінетичну енергію обертального руху однієї молекули кисню при температурі Т = 350 К, а також кінетичну енергію Е обертального руху всіх молекул кисню масою m = 4 г.
Відповідь: ξср. = 4,83.10-21 Дж; ξ об. = 363 Дж.
809. Визначити сумарну кінетичну енергію Е поступального руху всіх молекул газу, які знаходиться в посудині об’ємом V = 3 л під тиском р = 540 кПа.
Відповідь: ξ = 2,43 кДж.
810. Визначити середню кінетичну енергію однієї молекули водяної пари при температурі Т = 500 К.
Відповідь: ξср . = 2,07.10-20 Дж.
811. Визначити середню квадратичну швидкість  кв. молекул газу, який міститься у посудині об’ємом V = 2 л під тиском р = 200 кПа. Маса газу m=0,3 г.
кв. молекул газу, який міститься у посудині об’ємом V = 2 л під тиском р = 200 кПа. Маса газу m=0,3 г.
Відповідь: υкв . = 2.103 м/с.
812. Скільки молекул газу міститься у балоні місткістю V = 30 л при температурі Т = 300 К и тиску р = 5 МПА?
Відповідь: N = 3,6.1025.
813. Визначити середнє значення повної кінетичної енергії однієї молекули гелію, кисню і водяної пари при температурі Т = 400 К.
Відповідь: ξcр.1= 8,28.10-21 Дж; ξср.2= 1,38.10-20 Дж; ξср.3=1,65.10-20 Дж.
814. Знайти середню кінетичну енергію обертального руху всіх молекул, які містяться в 0,20 г водню при температурі 27оС.
Відповідь: ξср . = 249 Дж.
815. Тиск ідеального газу 10 мПа, концентрація молекул 8·1010 см-3. Визначити середню кінетичну енергію поступального руху однієї молекули і температуру газу.
Відповідь: ξср. = 1,87.10-19 Дж.
816. Визначити середнє значення повної кінетичної енергії однієї молекули аргону і водяної пари при температурі 500 К.
Відповідь: ξср.1 = 1,035.10-20 Дж; ξср.2 = 2,07.10-20 Дж.
817. У посудині, яка має форму кулі, радіус якої 0,1 м, знаходиться 56 г азоту. До якої температури можна нагріти посудину, якщо її стінки витримують тиск 15·106 Па?
Відповідь: Т = 3778 К.
818. Знайти відносне число молекул ΔN/N гелію, швидкості яких відрізняються від найбільш імовірної швидкості не більше ніж на 10 м/с, при температурах газу: а) T1 = 300 К, б) T2 = 600 К.
Відповідь: ΔN/N = 0,0074 ( для Т1); ΔN/N = 0,0052 (для Т2).
819. Обчислити середню квадратичну швидкість  кв. молекул азоту при температурі Т = 300 К. Знайти відносне число молекул, швидкості яких відрізняються від середньої квадратичної швидкості не більш ніж на 1%.
кв. молекул азоту при температурі Т = 300 К. Знайти відносне число молекул, швидкості яких відрізняються від середньої квадратичної швидкості не більш ніж на 1%.
Відповідь: υкв. = 517 м/с; ΔN/N = 0,017.
820. Обчислити середню арифметичну швидкість  молекул азоту при температурі Т = 300 К. Знайти відносне число молекул, швидкості яких відрізняються від середньої арифметичної швидкості не більш ніж на 0,5%.
молекул азоту при температурі Т = 300 К. Знайти відносне число молекул, швидкості яких відрізняються від середньої арифметичної швидкості не більш ніж на 0,5%.
Відповідь: ΔN/N = 0,020.
821. Азот займає об’єм V = 2,5 л при тиску р = 20 Па і температурі Т = 300 К. Яке число молекул азоту має швидкості, що відрізняються від найбільш ймовірної не більш ніж на 0,01%.
Відповідь: ΔN = 9,47.1014.
822. При якій температурі Т найбільш імовірна швидкість молекул азоту менша їх середньої квадратичної швидкості на 50 м/с?
Відповідь: Т = 82,26 К.
823. Знайти відносне число молекул  N/N, швидкості яких відрізняються не більше ніж на одну соту відсотка від найбільш ймовірної швидкості.
N/N, швидкості яких відрізняються не більше ніж на одну соту відсотка від найбільш ймовірної швидкості.
Відповідь:  N/N = 8,31.10-5.
N/N = 8,31.10-5.
824. Тиск повітря біля поверхні Землі р = 100 кПа. Вважаючи температуру повітря постійною і рівною Т = 270 К визначити концентра-цію молекул n повітря: а) біля поверхні Землі; б) на висоті h = 8 км. Молярна маса повітря 
Відповідь: n = 9,73.1024 1/м3.
825. На якій висоті h тиск повітря складає 80% тиску на рівні моря? Температуру до цієї висоти вважати постійною і рівною t = 7оС. Для повітря 
Відповідь: h = 1826 м.
826. На якій висоті h концентрація молекул водню складає 50% концентрації на рівні моря? Температуру вважати постійною і рівною 273 К. Прискорення вільного падіння постійне і дорівнює 9,8 м/с².
Відповідь: h = 5532 м.
827. У кабіні гвинтокрила барометр показує тиск p1 = 86 кПа. На якій висоті h летить гвинтокрил, якщо біля поверхні Землі тиск дорівнює p2 = 0,10 МПа. Вважати, що температура повітря постійна і дорівнює 280 К. Молярна маса повітря 
Відповідь: h = 1235 м.
828. У посудині ємністю 1 л утримується кисень масою 32 г. Визначити середнє число зіткнень молекул за секунду при температурі 100 К. Ефективний діаметр молекул кисню 0,36 нм.
Відповідь: zср. = 8,88.1010 1/с.
829. Визначити середню довжину і середню тривалість вільного пробігу молекул вуглекислого газу при температурі 400 К и тиску 1,36 Па. Ефективний діаметр молекули вуглекислого газу дорівнює 0,3 нм.
Відповідь: lср = 2,3.10-5 м; τ = 5,2.10-8 с.
830. У посудині ємністю 1 л знаходиться 4,4 г вуглекислого газу. Визначити середню довжину вільного пробігу молекул цього газу. Ефективний діаметр молекул вуглекислого газу 0,3 нм.
Відповідь: lср = 4,17.10-8 м.
831. Визначити коефіцієнт дифузії гелію при тиску 106 Па і температурі 27оС. Ефективний діаметр молекул гелію 0,22 нм.
Відповідь: D = 8,1.10-6 м2/с.
832. Визначити коефіцієнт внутрішнього тертя кисню при температурі 400 К. Ефективний діаметр молекул кисню 0,36 нм.
Відповідь: η = 1,58.10-5 кг/м.с.
833. У посудині ємністю 5 л утримується 40 г аргону. Визначити середнє число зіткнень молекул за одну секунду при температурі 400 К. Ефективний діаметр молекул аргону 0,35 нм.
Відповідь: <z> = 3.1010 c-1.
834. Визначити коефіцієнт внутрішнього тертя повітря при температурі 100 К. Ефективний діаметр молекул повітря 0,27 нм.
Відповідь: η = 1,34.10-5 кг/м.с.
835. Визначити коефіцієнт дифузії азоту при тиску 0,5·105 Па і температурі 127оС. Ефективний діаметр молекул азоту 0,38 нм.
Відповідь: D= 3,16.10-5 м2/с.
836. Коефіцієнт внутрішнього тертя кисню при нормальних умовах 1,9·10-4 кг/м·с. Визначити коефіцієнт теплопровідності кисню.
Відповідь: χ = 0,12 Вт/м.К.
837. Коефіцієнт дифузії водню при нормальних умовах 9,1·10-5 м²/с. Визначити коефіцієнт теплопровідності водню.
Відповідь: χ = 0,085 Вт/м.К.
838. Одноатомний газ був нагрітий при постійному тиску р = 90 кПа. У результаті його об’єм збільшився на ΔV = 2 см². Знайти: 1) виконану газом роботу; 2) збільшення внутрішньої енергії ΔU газу; 3) кількість теплоти Q, передану газу.
Відповідь: А = 18 Дж; ΔU = 27 Дж; Q = 45 Дж.
839. Аргон нагрівався при постійному тиску, причому йому була передано кількість теплоти Q = 50 кДж. Визначити збільшення внутрішньої енергії ΔU аргону і роботу А, виконану аргоном.
Відповідь: ΔU = 30 кДж; А = 20 кДж.
840. Три літри кисню знаходяться під тиском р = 0,15 МПа. Яку кількість теплоти Q треба надати кисню, щоб: а) при постійному об’ємі вдвічі збільшити тиск; б) при постійному тиску вдвічі збільшити об’єм?
Відповідь: Q1 = 1575 Дж; Q2 = 1125 Дж.
841. У закритій посудині знаходиться водень масою m1 = 12 г і азот масою m2 = 2 г. Знайти збільшення внутрішньої енергії ΔU цієї суміші при зміні її температури на ΔТ = 56 К.
Відповідь: ΔU = 7,06 кДж.
842. Азот масою m = 5 г нагрівається від температури t1 = 20о С при постійному тиску р = 150 кПа. Після нагрівання об’єм газу виявився рівним V2 =12 л. Знайти: а) кількість теплоти Q, отриману азотом; б) роботу А, виконану газом; в) збільшення внутрішньої енергії ΔU.
Відповідь: Q = 4,77 кМДж; А = 1,36 кДж; ΔU = 3,41 кДж.
843. Один моль газу ізотермічно розширюється при температурі Т = 300 К, причому його об’єм збільшується в три рази. Знайти: а) збільшення внутрішньої енергії ΔU газу; б) виконану газом роботу А; в) кількість теплоти Q, передану газу.
Відповідь: ΔU = 0; А = Q = 2739 Дж.
844. Азот масою 0,1 кг був ізобарно нагрітий від температури 200 К до температури 400 К. Визначити роботу, виконану газом, отриману ним теплоту і зміну внутрішньої енергії азоту.
Відповідь: ΔU = 14,839 кДж; А = 5,935 кДж;
845. Кисень нагрівається при незмінному тиску 80 кПа. Його об’єм збільшується від 1 м3 до 3м3. Визначити: зміну внутрішньої енергії кисню, роботу, виконану газом при розширенні, кількість теплоти, передану газу.
Відповідь: ΔU = 400 кДж; А = 160 кДж; Q = 560 кДж.
846. Водень масою 10 г нагріли на 200 К, причому газу було передано
40 кДж теплоти. Знайти зміну внутрішньої енергії газу і виконану ним роботу.
Відповідь: ΔU = 28,57 кДж; А = 11,43 кДж;
847. Розширюючись, водень виконав роботу в 6 кДж. Визначити кількість теплоти, передана газу, якщо процес протікав: а) ізобарно; б) ізотермічно.
Відповідь: Q1 = 21 кДж; Q2 = 6 кДж.
848. Визначити зміну ентропії 14 г азоту при ізобарному нагріванні його від 27 до 127оС.
Відповідь: ΔS = 4,18 Дж/К.
849. Як зміниться ентропія 2-х молів вуглекислого газу при ізотермічному розширенні, якщо об’єм газу збільшується у чотири рази.
Відповідь: ΔS = 23 Дж/К.
850. Знайти зміну ентропії при нагріванні 2 кг води від 0 до 100о С і наступному перетворенні її в пару при тій же температурі. Питома теплоємність паротворення r = 22,5·105 Дж/кг.
Відповідь: ΔS = 2745 Дж/К.
851. Знайти зміну ентропії при плавленні 2 кг свинцю і подальшому його охолодженні від 327 до 0оС. Питома теплота плавлення свинцю λ = 2,3·104 Дж/кг.
Відповідь: ΔS = 0,275 кДж/К.
852. Визначити зміну ентропії, що відбулася при змішуванні 2 кг води, що знаходиться при температурі 300 К і 4 кг води при температурі 370 К.
Відповідь: ΔS = 2324,9 Дж/К.
853. Змішали воду масою m1 = 5 кг при температурі Т = 280 К з водою масою m2 = 8 кг при температурі Т = 350 К. Знайти зміну ентропії, яка відбувається при змішуванні.
Відповідь: ΔS = 10497 Дж/К.
854. У результаті ізохорного нагрівання водню масою m = 1 г тиск р газу збільшився в 2 рази. Визначити зміну ентропії газу.
Відповідь: ΔS = 7,2 Дж/К.
855. Знайти зміну ентропії при ізобарному розширенні азоту масою
m = 4 г від об’єму V1 = 5 л до об’єму V2 = 9 л.
Відповідь: ΔS = 2,44 Дж/К.
856. Кисень масою m = 2 кг збільшив свій об’єм у n разів. Один раз процес ізотермічний, другий – адіабатний. Знайти зміну ентропії в кожному із зазначених процесів.
Відповідь: ΔS1 = 720 Дж/К; ΔS2 = 0.
857. Водень масою m = 100 г був ізобарно нагрітий так, що його об’єм збільшився в n = 3 рази, потім водень був ізохорично охолоджений так, що його тиск зменшився в n = 3 рази. Знайти зміну ентропії в ході зазначених процесів.
Відповідь: ΔS1 = 1597 Дж/К; ΔS2 = 1141 Дж/К.
ФІЗИКА ТВЕРДОГО ТІЛА
Основні формули
1. Розподіл вільних електронів у металі за енергіями при 0 К
dn(E) = 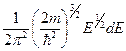 , (1)
, (1)
де m – маса електрона;
dn(Е) – концентрація вільних електронів, енергія яких перебуває в межах від Е до Е + dЕ (причому Е < Еf, де Еf – енергія рівня Фермі).
2. Енергія Фермі в металі при Т=0 К
Еf =  ,
,
де n – концентрація вільних електронів.
3. Питома електропровідність напівпровідника
 q(nbn + pbp), (2)
q(nbn + pbp), (2)
де q – заряд електрона;
n і p – концентрації носіїв заряду (електронів і дірок);
bn і bp – рухливості електронів і дірок.
У випадку провідності одного типу одним з доданків у виразі (2) можна знехтувати. Для власного напівпровідника слід враховувати, що n = p.
4. Залежність питомої електропровідності власного напівпровідника від температури
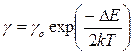 ,
,
де  Е – ширина забороненої зони напівпровідника;
Е – ширина забороненої зони напівпровідника;
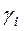 – константа, що майже не залежить від температури;
– константа, що майже не залежить від температури;
k – постійна Больцмана.
5. Холлівська різниця потенціалів дорівнює
Uн = Rн  I,
I,
де В – індукція магнетного поля;
а – товщина зразка;
I – сила струму в зразку.
Для напівпровідника із кристалічною граткою типу алмаза із провідністю одного типу постійна Холла дорівнює
Rн =  або Rн =
або Rн = 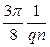 ,
,
для діркового й електронного напівпровідників, відповідно.
Постійна Холла для власного напівпровідника (при n = p)
Rн =  .
.
6. Сила струму в p-n переході
 ,
,
де Io – зворотний струм насичення;
U – зовнішня напруга, прикладена до p-n переходу.






