С. Г. Авдєєв, Т. І. Бабюк
О. С. Камінський
ЗБІРНИК ЗАДАЧ З ФІЗИКИ
Частина 3
(елементи квантової механіки, молекулярна фізика, статистична фізика, фізика твердого тіла, ядерна фізика)
Міністерство освіти і науки України
Вінницький національний технічний університет
С. Г. Авдєєв, Т. І. Бабюк
О. С. Камінський
ЗБІРНИК ЗАДАЧ З ФІЗИКИ
Частина 3
(елементи квантової механіки, молекулярна фізика, статистична фізика, фізика твердого тіла, ядерна фізика)
Вінниця
ВНТУ
УДК 530(078)
ББК 22.3я77
А18
Рекомендовано до друку Вченою радою Вінницького національного технічного університету Міністерства освіти і науки України (протокол № 5 від 24.12.09 р.)
Рецензенти:
І. О. Сівак, доктор технічних наук, професор
О. В. Осадчук, доктор технічних наук, професор
В. Г. Дзісь, кандидат фізико-математичних наук, доцент
Авдєєв, С. Г.
А18Збірник задач з фізики. Ч. 3 (елементи квантової механіки, молекулярна фізика, статистична фізика, фізика твердого тіла, ядерна фізика): навчальний посібник / С. Г. Авдєєв, Т. І. Бабюк, О. С. Камінський. – Вінниця: ВНТУ, 2010. – 84 с.
Збірник задач складається з розділів “Елементи квантової механіки, молекулярна фізика, статистична фізика, фізика твердого тіла, ядерна фізика”, які традиційно викладаються в одному триместрі. Кожен окремий розділ супроводжується короткими теоретичними викладками і прикладами розв’язування задач.
В першу чергу збірник задач призначений для організації та проведення практичних занять з курсу загальної фізики студентами вищих технічних навчальних закладів. Велика кількість і різноманітність задач, які ввійшли до збірника задач, дозволяє широко організовувати самостійну та індивідуальну роботу студентів.
УДК 53(078)
ББК 22.3я77
© С. Авдєєв, Т. Бабюк, О. Камінський, 2010
ЗМІСТ
Частина 3
Атом водню. Основні формули.................................................................. 4
Приклади розв’язування задач................................................................. 5
Елементи квантової механіки. Основні формули...................................... 8
Приклади розв’язування задач............................................................... 10
Задачі......................................................................................................... 15
Молекулярно-кінетична теорія. Основні формули.................................. 36
Приклади розв’язування задач............................................................... 41
Елементи термодинаміки. Основні формули........................................... 46
Приклади розв’язування задач............................................................... 48
Задачі......................................................................................................... 56
Фізика твердого тіла. Основні формули.................................................. 63
Приклади розв’язування задач................................................................ 65
Задачі......................................................................................................... 67
Фізика атомного ядра. Основні формули................................................ 69
Приклади розв’язування задач................................................................ 71
Задачі......................................................................................................... 74
Основна література................................................................................... 76
Деякі відомості з математики.................................................................... 77
Довідкові таблиці...................................................................................... 79
Частина 3
АТОМ ВОДНЮ
Основні формули
1. Електрони в атомі водню рухаються на окремих стаціонарних рівнях, на яких вони не випромінюють і не поглинають електромагнетних хвиль. Ці рівні мають дискретні значення моменту імпульсу
munrn= n  ,
,
де m – маса електрона;
un – лінійна швидкість орбітального руху;
rn – радіус n-го колового рівня;
n – порядковий номер стаціонарного рівня – головне квантове число;
 – стала Планка поділена на 2p (
– стала Планка поділена на 2p ( = h / 2p).
= h / 2p).
2. При переході електрона з одного стаціонарного рівня на інший випромінюється або поглинається квант енергії
hn = En2 – En1,
де En1, En2 – дискретні значення енергії електронів на відповідних енергетичних рівнях.
3. Радіус Боровської орбіти атома водню визначається за допомогою формули

де ε0 – електрична стала (ε0 = 8,85.10-12 Ф/м);
m – маса електрона (m = 9,1.10-31 кг);
е – елементарний заряд (е = 1,6.10-19 Кл)
4. Енергія електрона на n -му стаціонарному рівні

5. Енергія, яка випромінюється або поглинається атомом (іоном)
E = h 
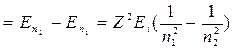 ,
,
де n1 й n2 – квантові числа, що відповідають енергетичним рівням, між якими відбувається перехід електрона;
Z – порядковий номер елементу в таблиці Менделєєва або число елементарних зарядів у ядрі атома.
6. Формула Бальмера
 = R Z2
= R Z2  ,
,
де  – довжина хвилі фотона;
– довжина хвилі фотона;
R – постійна Рідберга (R = 1,1.107 1/м)
Приклади розв’язування задач
Приклад 1. Електрон в атомі водню перейшов із четвертого енергетичного рівня на другий. Визначити енергію, випущеного при цьому, фотона.
Дано:
n2= 4
n1 = 2
_________
εф –?
Розв’язування. Для визначення енергії фотона скористаємося узагальненою формулою для водне-подібних іонів (формула Бальмера)
 , (1)
, (1)
де λ – довжина хвилі фотона;
R – постійна Рідберга;
Z – заряд ядра у відносних одиницях (при Z = 1 формула переходить в узагальнену формулу для водню і водне-подібних атомів);
n1 – номер орбіти, на яку перейшов електрон;
n2 – номер орбіти, з якої перейшов електрон (n1 й n2 – головні квантові числа).
Енергія фотона  ф виражається формулою
ф виражається формулою
 ф = hc /
ф = hc /  .
.
Помноживши обидві частини рівності (1) на hc, одержимо вираз для енергії фотона
 ф = Rhc Z2
ф = Rhc Z2  .
.
Вираз Rhc є енергією іонізації Еi атома водню, тому
 ф = Е i Z2
ф = Е i Z2  .
.
Обчислення виконаємо у позасистемних одиницях. Підставляючи дані з умови: Еi = 13,6 еВ; Z =1; n1 = 2; n2 = 4, одержимо
 ф = 13,6.12. (1/22 – ¼2) еВ = 13,6.3/16 еВ = 2,55 еВ.
ф = 13,6.12. (1/22 – ¼2) еВ = 13,6.3/16 еВ = 2,55 еВ.
Приклад 2. Електрон в іоні гелію (Не+) перебуває в основному стані. Визначити кінетичну, потенціальну й повну енергії електрона на цьому енергетичному рівні.
Дано:
Не+
n = 1
_________
Ек –?
Еп –?
W –?
Розв’язування. Відповідно до теорії Бора кінетична енергія електрона на стаціонарному рівні з номером n визначається формулою
Ек =  ,
,
а потенціальна енергія
Еп =  ,
,
де Z – заряд ядра (порядковий номер елементу в таблиці Менделєєва);
 n й rn – швидкість електрона й радіус енергетичного рівня, відповідно.
n й rn – швидкість електрона й радіус енергетичного рівня, відповідно.
Радіус n- го рівня дорівнює
rn =  , (1)
, (1)
а швидкість електрона на цьому рівні визначається виразом (відповідно до правила квантування орбіт).
 n =
n =  , (2)
, (2)
або з урахуванням формули (1),
 n =
n =  . (3)
. (3)
На енергетичному рівні доцентрова сила  дорівнює силі Кулона
дорівнює силі Кулона  , що зв’язує електрон з ядром,
, що зв’язує електрон з ядром,
 =
=  .
.
Тому потенціальна енергія електрона може бути подана у вигляді
Еп = -  = - mυ
= - mυ  = - 2Ек.
= - 2Ек.
При цьому повна енергія електрона на енергетичному рівні дорівнює
Е = Еп + Ек = - Ек.
Врахувавши формулу (3) знаходимо кінетичну енергію
Ек=  =
=  ,
,
З урахуванням того, що  = 1,05.10-34 Дж.с, m = 9,11.10-31 кг, rо = 0,529.10-10 м, для гелію Z = 2 й умова n = 1, одержимо
= 1,05.10-34 Дж.с, m = 9,11.10-31 кг, rо = 0,529.10-10 м, для гелію Z = 2 й умова n = 1, одержимо
Ек =  = 8,63.10-18 Дж =
= 8,63.10-18 Дж =  = 54,4 еВ,
= 54,4 еВ,
Еп = - 2Ек = - 108,8 еВ, Е = - Ек = - 54,4 еВ.
Відзначимо, що повна енергія електрона в основному стані (n = 1) може бути записана у вигляді
Е = - Z2Ei,
де Еi – енергія іонізації атома водню дорівнює 13,6 еВ.
Підставляючи в це рівняння Z = 2, одержимо вищезазначене значення енергії Е = - 54,4 еВ.






