ћетою лабораторноњ роботи Ї досл≥дженн€ кислотност≥ дощу, поталоњ води (сн≥гу).
ислотн≥сть дощу, поталоњ води (сн≥гу) визначаЇтьс€ присутн≥стю в атмосфер≥ забруднюючих речовин: оксид≥в вуглецю (IV), с≥рки (IV ≥ VI) та оксид≥в азоту р≥зного ступен€ окислюванн€.
ѕри в≥дсутност≥ в атмосфер≥ основних забруднюючих речовин:  ,
,  ,
,  ≥
≥  , кислотн≥сть дощу залежить т≥льки в≥д вм≥сту в≥льноњ розчиненоњ вуглекислоти.
, кислотн≥сть дощу залежить т≥льки в≥д вм≥сту в≥льноњ розчиненоњ вуглекислоти.

ƒощова вода у цьому випадку маЇ рЌ у межах до 5,6.
ѕри на€вност≥ в атмосфер≥ оксид≥в с≥рки та азоту кислотн≥сть дощу зб≥льшуЇтьс€, рЌ знижуЇтьс€ значно нижче 4,5.
ѕроцеси, що переб≥гають у цьому випадку в атмосфер≥, можна описати у такий спос≥б:







«начна р≥зниц€ у значенн€х рЌ пов'€зана з р≥зною силою кислот:  ;
;  ;
;  .
.
ислотн≥стю дощовоњ (поталоњ) води називаЇтьс€ вм≥ст у вод≥ речовин, що вступають у реакц≥ю ≥з сильними лугами. ќбТЇм 0,1 н. розчину лугу, витрачений на титруванн€ таких речовин, в≥дпов≥даЇ загальн≥й кислотност≥ води У–Ф.
“а частина загальноњ кислотност≥ дощу, при €к≥й рЌ знижуЇтьс€ до 4,5 ≥ нижче, називаЇтьс€ в≥льною кислотн≥стю води У“Ф.
ислотн≥сть води визначають титруванн€м титрованого розчину сильноњ основи.
≥льк≥сть 0,1 н. розчину сильноњ основи, при витрат≥ €кого рЌ розчину дос€гаЇ значенн€ 4,5, в≥дпов≥даЇ в≥льн≥й кислотност≥ У“Ф (титруЇтьс€ т≥льки сильна кислота).
якщо титруванн€ рЌ розчину дос€гаЇ значенн€ 8,3, визначаЇ загальну кислотн≥сть У–Ф, при цьому титруЇтьс€ ≥ слабка ≥ сильна кислота.
–еактиви:
≤ндикатори фенолфталењн, метиловий оранжевий
0,1 н. розчин њдкого натру (або њдкого кал≥ю)
’≥д визначенн€. ѕопередньо визначають на€вн≥сть сильних кислот за метиловим оранжевим (зм≥на забарвленн€ з жовтого на малинове в≥дбуваЇтьс€ в ≥нтервал≥ рЌ 5,5-4,5). якщо попереднЇ визначенн€ показало на€вн≥сть в≥льноњ кислоти, провод€ть к≥льк≥сне визначенн€ в≥льноњ та загальноњ кислотност≥.
¬изначенн€ в≥льноњ кислотност≥ У“Ф. ƒо 100 мл досл≥джуваноњ води доливають ≥ндикатор Ц метиловий оранжевий ≥ титрують 0,1 н. розчином њдкого натру до по€ви жовтого забарвленн€.
 ,
,
де  Ц обТЇм досл≥джуваноњ води;
Ц обТЇм досл≥джуваноњ води;
 Ц обТЇм розчину
Ц обТЇм розчину  , що п≥шов на титруванн€;
, що п≥шов на титруванн€;
 Ц нормальн≥сть розчину
Ц нормальн≥сть розчину  .
.
¬изначенн€ загальноњ кислотност≥ У–Ф. ƒо 100 мл досл≥джуваноњ води доливають ≥ндикатор Ц фенолфталењн ≥ титрують 0,1 н. розчином њдкого натру до по€ви рожевого забарвленн€.
 ,
,
де  Ц обТЇм води;
Ц обТЇм води;
 Ц обТЇм розчину
Ц обТЇм розчину  , що п≥шов на титруванн€ за фенолфталењном;
, що п≥шов на титруванн€ за фенолфталењном;
 Ц нормальн≥сть розчину
Ц нормальн≥сть розчину  .
.
ѕитанн€:
1. ƒайте визначенн€ кислотност≥ поталоњ води.
2. як≥ забруднююч≥ речовини, присутн≥ у потал≥й вод≥, зумовлюють кислотн≥сть?
3. ўо таке потенц≥ометричне титруванн€?
4. Ќазв≥ть основн≥ методи електрометричного титруванн€?
5. ” €ких межах знаходитьс€ водневий показник дл€ кислого середовища?
6. ” €ких межах знаходитьс€ водневий показник дл€ лужного середовища?
7. як≥ ≥ндикатори використовуютьс€ дл€ лабораторного досл≥дженн€ кислотност≥ поталоњ води?
|
|
|
8. як≥ луги використовуютьс€ дл€ визначенн€ кислотност≥ поталоњ води?
9. ƒайте визначенн€ в≥льноњ кислотност≥.
10. як визначаЇтьс€ кислотн≥сть поталоњ води?
11. ѕри на€вност≥ €ких речовин в атмосфер≥ зб≥льшуЇтьс€ кислотн≥сть поталоњ води?
12. ƒайте визначенн€ загальноњ кислотност≥.
13. Ќазв≥ть основн≥ способи визначенн€ концентрац≥њ розчин≥в.
14. яких правил сл≥д дотримуватись при готуванн≥ нормальних розчин≥в складних речовин (кислот, луг≥в, солей)?
15. ƒайте визначенн€ нормальност≥ розчину.
Ћабораторна робота 4
¬»«Ќј„≈ЌЌя ¬ћ≤—“” «јЋ≤«ј ” ѕќ“јЋ≤… ¬ќƒ≤, “ј ¬ќƒ≤ √ќ—ѕќƒј–—№ ќ-ѕ»“Ќќ√ќ ѕ–»«Ќј„≈ЌЌя
ќЋќ–»ћ≈“–»„Ќ»ћ ћ≈“ќƒќћ
ћетою лабораторноњ роботи Ї визначенн€ вм≥сту зал≥за у вод≥, що застосовуЇтьс€ дл€ господарсько-питного водопостачанн€, колориметричним методом.
«ал≥зо пост≥йно Ї присутн≥м у поверхневих ≥ п≥дземних водах у вигл€д≥ солей  (II) ≥ солей
(II) ≥ солей  (III); тобто у вигл€д≥ ≥он≥в
(III); тобто у вигл€д≥ ≥он≥в  ≥
≥  . √ранично припустима концентрац≥€ зал≥за у питн≥й вод≥ не повинна перевищувати 0,3 мг/л. ѕ≥двищена к≥льк≥сть зал≥за у вод≥ додаЇ њй буре забарвленн€ ≥ Ђзалозистийї смак. ¬м≥ст зал≥за у вод≥ визначають колориметрично на основ≥ реакц≥њ ≥он≥в
. √ранично припустима концентрац≥€ зал≥за у питн≥й вод≥ не повинна перевищувати 0,3 мг/л. ѕ≥двищена к≥льк≥сть зал≥за у вод≥ додаЇ њй буре забарвленн€ ≥ Ђзалозистийї смак. ¬м≥ст зал≥за у вод≥ визначають колориметрично на основ≥ реакц≥њ ≥он≥в  з родан≥дом кал≥ю або амон≥ю. ѕри цьому переб≥гаЇ реакц≥€:
з родан≥дом кал≥ю або амон≥ю. ѕри цьому переб≥гаЇ реакц≥€:
 ,
,
або 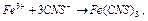
у результат≥ €коњ створюЇтьс€ €скраво-червоний родан≥д зал≥за, ≥нтенсивн≥сть забарвленн€ €кого пропорц≥йна концентрац≥њ зал≥за. ƒл€ визначенн€ вм≥сту зал≥за (II) його попередньо окислюють до зал≥за (III).
÷им методом можна визначити 0,05-4,0 зал≥за у 1 л води з точн≥стю ±0,05 мг/л.
≤нтенсивн≥сть забарвленн€ вим≥рюють на фотоелектроколориметр≥.
–еактиви:
родан≥д кал≥ю або амон≥ю
сол€на кислота
персульфат амон≥ю
’≥д визначенн€. ѕобудова кал≥брувальноњ кривоњ. √отують стандартний розчин ≥з вм≥стом ≥он≥в  0,1 мг/л. « отриманого стандартного розчину готують 5 проб по 50 мл у кожн≥й, з концентрац≥€ми ≥он≥в
0,1 мг/л. « отриманого стандартного розчину готують 5 проб по 50 мл у кожн≥й, з концентрац≥€ми ≥он≥в  : 0,2; 0,4; 0,6; 0,8; 1,0 мг/л ≥ по 2 мл родан≥ду кал≥ю або амон≥ю. ”с≥ розчини забарвлюютьс€ у червоний кол≥р р≥вноњ ≥нтенсивност≥. ѕ≥сл€ цього, на фотоколориметр≥ визначають оптичн≥ щ≥льност≥ цих розчин≥в, починаючи з першого (Lкювети=10 мм, св≥тлоф≥льтр син≥й).
: 0,2; 0,4; 0,6; 0,8; 1,0 мг/л ≥ по 2 мл родан≥ду кал≥ю або амон≥ю. ”с≥ розчини забарвлюютьс€ у червоний кол≥р р≥вноњ ≥нтенсивност≥. ѕ≥сл€ цього, на фотоколориметр≥ визначають оптичн≥ щ≥льност≥ цих розчин≥в, починаючи з першого (Lкювети=10 мм, св≥тлоф≥льтр син≥й).
¬им≥ривши оптичн≥ щ≥льност≥ вс≥х розчин≥в, будують кал≥брувальну криву, в≥дкладаючи на ос≥ абсцис концентрац≥њ, а по ос≥ ординат Ц в≥дпов≥дн≥ оптичн≥ щ≥льност≥.
¬изначенн€ загального вм≥сту зал≥за у вод≥. ” колбу, Їмн≥стю 200 мл, наливають 50 мл досл≥джуваноњ води (у випадку залозистих вод, що м≥ст€ть зал≥за б≥льш 4,0 мг/л, беруть менший обТЇм води ≥ розбавл€ють дистильованою водою до 50 мл), додають 1 мл розведеноњ (1:1) сол€ноњ кислоти дл€ створенн€ кислотноњ реакц≥њ (реакц≥€ солей зал≥за (III) з родан≥дом кал≥ю та амон≥ю переб≥гаЇ до к≥нц€ у кислому середовищ≥) ≥ додають 2-3 кристалика персульфату амон≥ю дл€ окислюванн€ зал≥за (II) у зал≥зо (III).
Ќагр≥вають на вод€н≥й бан≥ прот€гом 10 хв, тому що окислюванн€ краще переб≥гаЇ при нагр≥ванн≥, прохолоджують, пот≥м додають 2 мл 50%-го розчину родан≥ду кал≥ю або амон≥ю ≥ вим≥рюють оптичну щ≥льн≥сть (св≥тлоф≥льтр син≥й, Lкювети=10 мм). ¬м≥ст зал≥за (’, мг/л) знаход€ть за кал≥брувальною кривою.
¬м≥ст зал≥за (II) ( ) у вод≥ визначають аналог≥чно, без добавки персульфату амон≥ю, тому розчин не кип'€т€ть. ≥льк≥сть зал≥за (II) знаход€ть, в≥дн≥маючи в≥д загальноњ к≥лькост≥ зал≥за к≥льк≥сть зал≥за (III).
) у вод≥ визначають аналог≥чно, без добавки персульфату амон≥ю, тому розчин не кип'€т€ть. ≥льк≥сть зал≥за (II) знаход€ть, в≥дн≥маючи в≥д загальноњ к≥лькост≥ зал≥за к≥льк≥сть зал≥за (III).
–езультати досл≥джень записують у вигл€д≥ таблиц≥:
|
|
|
| Ќомер проби | «агальний вм≥ст зал≥за, мг/л | ¬м≥ст | |
| «ал≥за (III), мг/л | «ал≥за (II), мг/л | ||
ѕитанн€:
1. яка гранично припустима концентрац≥€ зал≥за у питн≥й вод≥ зг≥дно √ќ—“ 2874-82
2. —утн≥сть фотоколориметричного методу визначенн€ вм≥сту зал≥за у питн≥й вод≥?
3. « €кою метою у досл≥дженн€х використовуЇтьс€ сол€на кислота?
4. « €кою метою у досл≥дженн€х використовуЇтьс€ персульфат амон≥ю?
5. ” €кому вигл€д≥ зал≥зо Ї присутн≥м у поверхневих ≥ п≥дземних водах?
Ћабораторна робота 5
¬»«Ќј„≈ЌЌя –ќ«„»Ќ≈Ќќ√ќ ” ¬ќƒ≤ »—Ќё
ћетою лабораторноњ роботи Ї визначенн€ розчиненого у вод≥ кисню йодометричним методом.
исень Ї одним з найважлив≥ших розчинених газ≥в, що пост≥йно Ї присутн≥м у поверхневих водах, режим €кого значною м≥рою визначаЇ б≥олог≥чний стан водойм.
√оловним джерелом надходженн€ кисню у поверхнев≥ води Ї процеси його поглинанн€ з атмосфери ≥ вид≥ленн€ у результат≥ його фотосинтезу водними рослинами. Ўвидк≥сть цього процесу п≥двищуЇтьс€ з≥ зниженн€м температури ≥ п≥двищенн€м атмосферного тиску.
исень також надходить у водойми з дощовими ≥ сн≥говими водами, що звичайно киснем перенасичен≥.
—поживанн€ кисню у вод≥ зв'€зано з х≥м≥чними ≥ б≥ох≥м≥чними процесами окислюванн€ орган≥чних ≥ неорган≥чних ( ,
,  ,
,  ,
,  ,
,  ,
,  та ≥н.), а також з подихом водних орган≥зм≥в. Ўвидк≥сть споживанн€ кисню зб≥льшуЇтьс€ з п≥двищенн€м температури, к≥лькост≥ бактер≥й та ≥нших водних орган≥зм≥в, що п≥ддаютьс€ х≥м≥чному ≥ б≥ох≥м≥чному окислюванню.
та ≥н.), а також з подихом водних орган≥зм≥в. Ўвидк≥сть споживанн€ кисню зб≥льшуЇтьс€ з п≥двищенн€м температури, к≥лькост≥ бактер≥й та ≥нших водних орган≥зм≥в, що п≥ддаютьс€ х≥м≥чному ≥ б≥ох≥м≥чному окислюванню.
–озчинений кисень у поверхневих водах знаходитьс€ у вигл€д≥ молекул  . –озчинн≥сть його росте з≥ зниженн€м температури, з≥ зниженн€м м≥нерал≥зац≥њ ≥ п≥двищенн€м тиску.
. –озчинн≥сть його росте з≥ зниженн€м температури, з≥ зниженн€м м≥нерал≥зац≥њ ≥ п≥двищенн€м тиску.
” поверхневих водах вм≥ст розчиненого кисню може коливатис€ в≥д 0 до 14 мг/л ≥ п≥ддаЇтьс€ значним сезонним ≥ добовим коливанн€м. ” р≥чкових водах найб≥льш висок≥ концентрац≥њ спостер≥гаютьс€ звичайно в ос≥нню пору, найб≥льш низьк≥ Ц взимку, коли у результат≥ створенн€ крижаного покриву припин€Їтьс€ надходженн€ кисню з атмосфери. ƒеф≥цит кисню част≥ше спостер≥гаЇтьс€ у замкнутих забруднених водоймах, а також у водоймах, що м≥ст€ть велику к≥льк≥сть гумусових речовин.
онцентрац≥€ кисню визначаЇ величину окислювально-в≥дновного потенц≥алу ≥, значною м≥рою, напр€мок ≥ швидк≥сть процесу х≥м≥чного ≥ б≥ох≥м≥чного окислюванн€ орган≥чних ≥ неорган≥чних сполук.
исневий режим глибоко впливаЇ на житт€ водойм. ћ≥н≥мальний вм≥ст розчиненого кисню, що забезпечуЇ нормальний розвиток риб, складаЇ близько 5 мг/л. «ниженн€ концентрац≥њ кисню до 2 мг/л викликаЇ масову загибель риби. Ќеспри€тливо позначаЇтьс€ на њхньому стан≥ ≥ перенасиченн€ води киснем.






