ћ≤Ќ≤—“≈–—“¬ќ ќ—¬≤“» ≤ Ќј” » ” –јѓЌ»
—’≤ƒЌќ” –јѓЌ—№ »… Ќј÷≤ќЌјЋ№Ќ»… ”Ќ≤¬≈–—»“≈“
≥мен≥ ¬олодимира ƒал€
ћ≈“ќƒ»„Ќ≤ ¬ ј«≤¬ »
до виконанн€ лабораторних роб≥т
з дисципл≥ни У’≥м≥€ води та атмосфериФ
(дл€ студент≥в спец≥альност≥ Ућ≥ське буд≥вництво
та господарствоФ)
«ј“¬≈–ƒ∆≈Ќќ
на зас≥данн≥ кафедри
буд≥вництва
ѕротокол є 4 в≥д 10.11.2009 р.
Ћуганськ 2009
”ƒ 69.003:658.114.7
ћетодичн≥ вказ≥вки до виконанн€ лабораторних роб≥т з дисципл≥ни У’≥м≥€ води та атмосфериФ. ’≥м≥€ води (дл€ студент≥в спец≥альност≥ Ућ≥ське буд≥вництво та господарствоФ)/ ”кл.: Ѕ≥лошицька Ќ.≤. Ц Ћуганськ: ¬ид-во —Ќ” ≥м. ¬. ƒал€, 2009. Ц 45 с.
” методичних вказ≥вках викладено методику визначенн€ ф≥зико-х≥м≥чних властивостей води.
ћетодичн≥ вказ≥вки призначено дл€ студент≥в денноњ та заочноњ форм навчанн€ спец≥альност≥ Ућ≥ське буд≥вництво та господарствоФ.
”кладач: Ќ. ≤. Ѕ≥лошицька, к.т.н., доцент
–ецензент Ћ.—. —ав≥н, д.т.н., професор кафедри еколог≥њ ѕридн≥провськоњ державноњ академ≥њ буд≥вництва та арх≥тектури
¬—“”ѕ
Ќайчаст≥ше доводитьс€ робити анал≥з води, щоб оц≥нити њњ агресивн≥сть стосовно бетону. ” цьому випадку визначають рЌ, сухий залишок, загальну лужн≥сть (або кислотн≥сть),  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  , вуглекислоту в≥льну й агресивну (останню можна знаходити розрахунковим способом). јгресивн≥сть води стосовно бетону встановлюють шл€хом з≥ставленн€ результат≥в х≥м≥чного анал≥зу з нормами агресивност≥.
, вуглекислоту в≥льну й агресивну (останню можна знаходити розрахунковим способом). јгресивн≥сть води стосовно бетону встановлюють шл€хом з≥ставленн€ результат≥в х≥м≥чного анал≥зу з нормами агресивност≥.
якщо воду анал≥зують ≥з метою з'€сувати њњ придатн≥сть €к воду зам≥шуванн€, то в н≥й визначають т≥льки рЌ, сухий залишок ≥  . јнал≥зи води за спец≥альним завданн€м можуть складатис€ ≥з ц≥лого р€ду ≥нших визначень, наприклад окислюваност≥, вм≥сту
. јнал≥зи води за спец≥альним завданн€м можуть складатис€ ≥з ц≥лого р€ду ≥нших визначень, наприклад окислюваност≥, вм≥сту  ,
,  ,
,  ,
,  та ≥н.
та ≥н.
–езультати анал≥зу вод виражають у мг/л ≥ мг-екв/л. ѕри вираженн≥ результат≥в анал≥зу в мг-екв/л можна встановити к≥льк≥сне сп≥вв≥дношенн€ м≥ж позитивно та негативно зар€дженими ≥онами, ви€вити њхнЇ взаЇмне насиченн€ й оц≥нити точн≥сть виконаних визначень: при повному та правильному анал≥з≥ води сума м≥л≥грам-екв≥валент≥в кат≥он≥в  дор≥внюЇ сум≥ м≥л≥грам-екв≥валент≥в ан≥он≥в
дор≥внюЇ сум≥ м≥л≥грам-екв≥валент≥в ан≥он≥в  .
.
≥льк≥сть води, необх≥дноњ дл€ досл≥дженн€, залежить в≥д необх≥дноњ точност≥ та призначенн€ анал≥зу, а також в≥д ступен€ м≥нерал≥зац≥њ води (слабком≥нерал≥зованих вод потр≥бно б≥льше (в≥д 1 до 2 л), чим сильном≥нерал≥зованих (в≥д 0,5 до 1, 5 л)).
—початку визначають рЌ води та рЌ-метр≥ не ф≥льтруючи њњ. якщо не потр≥бно дуже високоњ точност≥, то визначають рЌ за ≥ндикаторними пап≥рц€ми, на к≥нц€х €ких нанесено к≥лька кольорових смужок ≥з указ≥вкою рЌ. рапельку досл≥джуваноњ води нанос€ть на в≥льне в≥д смужок м≥сце пап≥рц€. «абарвленн€, що з'€вилос€, з≥ставл€ють ≥з забарвленн€м смуг. ÷ей метод дозвол€Ї визначати рЌ ≥з точн≥стю 0,1-0,2.
ѕ≥сл€ визначенн€ рЌ воду ф≥льтрують через сухий щ≥льний ф≥льтр. якщо ф≥льтрат мутний, його повторно ф≥льтрують. якщо ж ≥ п≥сл€ повторного ф≥льтруванн€ не вдаЇтьс€ одержати прозорого ф≥льтрату, застосовують суперф≥льтри.
|
|
|
јнал≥з води починають ≥з визначенн€ загальноњ, карбонатноњ й г≥дрокарбонатноњ лужност≥, оск≥льки лужн≥сть води може зм≥нюватис€.
ќ—Ќќ¬Ќ≤ ѕќЋќ∆≈ЌЌя јЌјЋ≤“»„Ќ»’ ћ≈“ќƒ≤¬,
«ј—“ќ—ќ¬”¬јЌ»’ ѕ–» јЌјЋ≤«≤ ¬ќƒ»
омплексометр≥€
омплексометричний метод заснований на використанн≥ здатност≥ де€ких ам≥нопол≥карбонових кислот ≥ њхн≥х солей-комплексон≥в утворювати з кат≥онами розчинн≥ комплексн≥ сполуки Ц комплексонати. ” цей час в≥домо р€д комплексон≥в, з €ких найб≥льше практичне застосуванн€ одержала двунатр≥Їва с≥ль етиленд≥ам≥нотетраоцтовоњ кислоти, тобто комплексон III, або трилон Ѕ* Ц  . ћехан≥зм взаЇмод≥њ комплексона III з кат≥онами пол€гаЇ в тому, що у вод€ному розчин≥ цей комплексон дисоц≥юЇ на ≥они за р≥вн€нн€м
. ћехан≥зм взаЇмод≥њ комплексона III з кат≥онами пол€гаЇ в тому, що у вод€ному розчин≥ цей комплексон дисоц≥юЇ на ≥они за р≥вн€нн€м

де  Ц умовне позначенн€ ан≥она комплексона III.
Ц умовне позначенн€ ан≥она комплексона III.
ѕри цьому ан≥он  утворюЇ комплексн≥ сполуки з кат≥онами:
утворюЇ комплексн≥ сполуки з кат≥онами:
дл€ двовалентних кат≥он≥в

або в загальному вигл€д≥

де  Ц валентн≥сть кат≥она.
Ц валентн≥сть кат≥она.
як видно ≥з цих р≥вн€нь, грам-≥он комплексона III завжди зв'€зуЇ грам-≥он металу незалежно в≥д валентност≥ останнього. ѕри цьому зв≥льн€ютьс€ два грам-≥они водню. ƒл€ того, щоб забезпечити значенн€ рЌ середовища, необх≥дне дл€ утворенн€ комплексоната, застосовують буферний розчин.
ѕри х≥м≥чному анал≥з≥ буд≥вельних матер≥ал≥в застосовують пр€ме та зворотне титруванн€. ” першому випадку пробу перевод€ть у розчин, у €кому забезпечують необх≥дне значенн€ рЌ. ќтриманий розчин титрують комплексоном III. р≥м комплексона III в≥дом≥ комплексон II Ц етиленд≥ам≥нтетраоцтова кислота  (≈ƒ“ј), а також комплексон I Ц н≥трилотриоцтова кислота
(≈ƒ“ј), а також комплексон I Ц н≥трилотриоцтова кислота  (HTA). –озчин комплексона III необх≥дно збер≥гати в сул≥њ з пол≥етилену.
(HTA). –озчин комплексона III необх≥дно збер≥гати в сул≥њ з пол≥етилену.
«воротне титруванн€ застосовують у трьох випадках:
1) кат≥он, що визначаЇтьс€, не може бути утриманий у розчин≥ при значенн≥ рЌ, необх≥дному дл€ утворенн€ комплексноњ сполуки;
2) в≥дсутн≥й в≥дпов≥дний ≥ндикатор на зумовлений кат≥он;
3) комплексна сполука зумовленого металу з комплексоном III утворюЇтьс€ не миттЇво, а в час≥ (наприклад, при визначенн≥ алюм≥н≥ю).
ѕри зворотному титруванн≥ додають в анал≥зований розчин надлишок комплексона III, а пот≥м його в≥дтитровують титрованим розчином сол≥, наприклад  ,
,  та ≥н.
та ≥н.
ѕри комплексометричному титруванн≥ використовують метал≥ндикатори, €к≥ утворюють ≥з даним кат≥оном ≥нтенсивно забарвлену комплексну сполуку. ќднак вона менш м≥цна, н≥ж сполука кат≥она з комплексоном III, тому останн≥й вит≥сн€Ї кат≥он з комплексноњ сполуки, утвореноњ кат≥оном з ≥ндикатором.
” момент дос€гненн€ екв≥валентноњ точки, тобто коли весь кат≥он зв'€зуЇтьс€ комплексоном III, виникаЇ забарвленн€ в≥льного ≥ндикатора, що в≥др≥зн€Їтьс€ в≥д забарвленн€ комплексноњ з ним сполуки.
Ќайб≥льш часто вживають наступн≥ ≥ндикатори: ер≥охром чорний “, кислотний хром син≥й , кислотний хром темно-син≥й (при визначенн≥  та
та  ); мурексид, флуорексон (при визначенн≥
); мурексид, флуорексон (при визначенн≥  ) та ≥н.
) та ≥н.
ѕри комплексометричному титруванн≥ екв≥валентна точка може бути визначена не т≥льки в≥зуально, але й амперометрично або фотометрично (фотометричне титруванн€).
омплексометричний метод вин€тково простий, не вимагаЇ застосуванн€ дорогоњ апаратури та деф≥цитних реактив≥в. ÷им методом визначають вм≥ст зал≥за, алюм≥н≥ю, магн≥ю, кальц≥ю в природних та штучних сил≥катах, шлаках, карбонатних породах, у матер≥алах з високим вм≥стом глинозему, вод≥ та ≥н.
|
|
|
‘отоколориметр≥€
‘отоколориметричний метод заснований на пор≥вн€нн≥ забарвленн€ розчин≥в шл€хом вим≥ру њхньоњ оптичноњ щ≥льност≥.
¬≥дпов≥дно до об'Їднаного закону Ѕугера Ц Ћамберта Ц Ѕера оптична щ≥льн≥сть розчину, або екстинкц≥€, пр€мо пропорц≥йна концентрац≥њ поглинаючоњ речовини, товщин≥ шару розчину й мол€рному коеф≥ц≥Їнту погашенн€:
 (1)
(1)
де 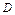 Ц оптична щ≥льн≥сть розчину;
Ц оптична щ≥льн≥сть розчину;
 Ц мол€рний коеф≥ц≥Їнт погашенн€;
Ц мол€рний коеф≥ц≥Їнт погашенн€;
 Ц концентрац≥€ речовини, що поглинаЇ св≥тло, г-моль/л;
Ц концентрац≥€ речовини, що поглинаЇ св≥тло, г-моль/л;
 Ц товщина поглинаючого шару забарвленого розчину, см.
Ц товщина поглинаючого шару забарвленого розчину, см.
√раф≥чно така залежн≥сть виражаЇтьс€ пр€мою л≥н≥Їю. –≥вн€нн€ (1) справедливо т≥льки дл€ монохроматичного св≥тла. «вичайно фотоколориметричн≥ вим≥ри провод€ть у пол≥хроматичному св≥тл≥. ” цьому випадку в р≥вн€нн€ (1) зам≥сть мол€рного коеф≥ц≥Їнта погашенн€  входить значенн€
входить значенн€ 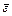 середнього мол€рного коеф≥ц≥Їнта погашенн€ речовини, що залежить в≥д характеристики св≥тлоф≥льтра
середнього мол€рного коеф≥ц≥Їнта погашенн€ речовини, що залежить в≥д характеристики св≥тлоф≥льтра  .
.
¬≥дхиленн€ в≥д л≥н≥йноњ залежност≥ м≥ж концентрац≥Їю й оптичною щ≥льн≥стю може бути зумовлено й ≥ншими причинами, наприклад дисоц≥ац≥Їю забарвленоњ сполуки. ” таких випадках забарвлений розчин розбавл€ють не чистим розчинником, а розчином реактиву, що маЇ концентрац≥ю, р≥вну надлишков≥й концентрац≥њ реактиву у вих≥дному забарвленому розчин≥. “ому що розведенн€ забарвленоњ сполуки в цьому випадку в≥дбуваЇтьс€ при пост≥йн≥й надлишков≥й концентрац≥њ реактиву, то ступ≥нь дисоц≥ац≥њ забарвленоњ сполуки залишаЇтьс€ незм≥нним, ≥ закон Ѕера практично не порушуЇтьс€.
ожне колориметричне визначенн€ складаЇтьс€ ≥з двох стад≥й: одержанн€ забарвленого розчину й безпосередн≥й вим≥р його оптичноњ щ≥льност≥. Ќа перш≥й стад≥њ анал≥зовану речовину перевод€ть у розчин, у €кий додають в≥дпов≥дн≥ реагенти, щоб одержати забарвлену сполуку. ≤нод≥ при колориметричному визначенн≥ використовують ≥ забарвленн€ ≥он≥в (наприклад, при визначенн≥ хрому та марганцю). «абарвлен≥ сполуки в б≥льшост≥ випадк≥в комплексн≥ або внутр≥шньокомплексн≥. ≤нтенсивн≥сть забарвленн€ розчин≥в цих сполук залежить в≥д њхн≥х властивостей ≥ складу середовища.
—т≥йк≥сть будь-€коњ комплексноњ сполуки 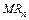 характеризуЇтьс€ константою дисоц≥ац≥њ (константою нест≥йкост≥).
характеризуЇтьс€ константою дисоц≥ац≥њ (константою нест≥йкост≥).
 (2)
(2)
ћ≥цн≥сть забарвленоњ сполуки та њњ ст≥йк≥сть у вод€них розчинах зб≥льшуютьс€ з≥ зменшенн€м константи нест≥йкост≥. „им вище м≥цн≥сть забарвленого комплексу  , тим менше залишаЇтьс€ ≥он≥в
, тим менше залишаЇтьс€ ≥он≥в  , не зв'€заних з реактивом
, не зв'€заних з реактивом  ,тим б≥льше точн≥сть ≥ чутлив≥сть колориметричного визначенн€, тим менше позначаЇтьс€ вплив сторонн≥х ≥он≥в, що Ї присутн≥ми у розчин≥.
,тим б≥льше точн≥сть ≥ чутлив≥сть колориметричного визначенн€, тим менше позначаЇтьс€ вплив сторонн≥х ≥он≥в, що Ї присутн≥ми у розчин≥.
ѕри колориметруванн≥ забарвлена сполука зумовленого ≥она повинна бути досить ст≥йкою  , б≥льш м≥цною, чим можлив≥ сполуки цього ≥она з ≥ншими компонентами, що Ї присутн≥ми у розчин≥, ≥ мати пост≥йний склад. —т≥йке забарвленн€ вона повинна збер≥гати прот€гом усього пер≥оду колориметруванн€ (не менш 5-10 хв).
, б≥льш м≥цною, чим можлив≥ сполуки цього ≥она з ≥ншими компонентами, що Ї присутн≥ми у розчин≥, ≥ мати пост≥йний склад. —т≥йке забарвленн€ вона повинна збер≥гати прот€гом усього пер≥оду колориметруванн€ (не менш 5-10 хв).
ѕри колориметруванн≥ величина рЌ середовища повинна бути обов'€зково пост≥йною. «м≥на кислотност≥ середовища приводить до зм≥ни ≥нтенсивност≥ забарвленн€ розчину й, таким чином, ви€вл€Їтьс€ джерелом помилок. ÷е €вище зумовлене р€дом причин: здатн≥стю забарвлених реактив≥в Ц слабких кислот (ал≥зарин, дитизон, арсеназо та ≥н.) Ц про€вл€ти ≥ндикаторн≥ властивост≥; зм≥ною ступеню зв'€заност≥ обумовленого ≥она в забарвлену сполуку; зм≥ною складу забарвленоњ сполуки або њњ руйнуванн€м.
Ќа друг≥й стад≥њ вим≥рюють оптичну щ≥льн≥сть розчин≥в. ƒл€ вим≥ру оптичноњ щ≥льност≥ розчину, а отже, ≥ концентрац≥њ застосовують фотоколориметри будь-€коњ марки (наприклад, типу ‘Ё -ћ, 1 ‘Ё -Ќ-52, 54, 57). ÷е Ц двопроменев≥ прилади ≥з двома фотоелементами, що мають однаков≥ принципов≥ схеми. ≤нтенсивн≥сть двох св≥тлових поток≥в зр≥внюЇтьс€ за допомогою зм≥нноњ щ≥линноњ д≥афрагми.
ќптичну щ≥льн≥сть розчин≥в вим≥рюють у т≥й област≥ спектра, у €к≥й обумовлена речовина поглинаЇ максимальну к≥льк≥сть промен≥в. ƒл€ цього на шл€ху св≥тлових поток≥в перед поглинаючими розчинами пом≥щають св≥тлоф≥льтри, €к≥ пропускають промен≥ лише в певному ≥нтервал≥ довжин хвиль  ≥ практично повн≥стю поглинають промен≥ хвиль ≥нших довжин.
≥ практично повн≥стю поглинають промен≥ хвиль ≥нших довжин.
|
|
|
„им вужче область максимального пропущенн€ промен≥в 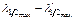 застосовуваного св≥тлоф≥льтру, тим вище його виб≥рков≥сть до промен≥в цього ≥нтервалу довжин хвиль. Ќайб≥льш ефективн≥ вузькосмугов≥ св≥тлоф≥льтри характеризуютьс€ найменшою розмит≥стю максимуму пропущенн€ (20-30 мкм).Ќабором таких св≥тлоф≥льтр≥в постачений фотоколориметр-нефелометр ‘Ё -Ќ-57. ‘отоколориметри ‘Ё -ћ мають чотири широкосмугових св≥тлоф≥льтри з наступним д≥апазоном максимального пропущенн€ промен≥в у мкм:син≥й в≥д 400 до 480, зелений в≥д 500 до 560, жовтий в≥д 580 до 650, червоний в≥д 650 до 750. ѕри вибор≥ св≥тлоф≥льтра нер≥дко керуютьс€ забарвленн€м досл≥джуваного розчину. ќднак такий спос≥б не може претендувати на точн≥сть (табл. 1).
застосовуваного св≥тлоф≥льтру, тим вище його виб≥рков≥сть до промен≥в цього ≥нтервалу довжин хвиль. Ќайб≥льш ефективн≥ вузькосмугов≥ св≥тлоф≥льтри характеризуютьс€ найменшою розмит≥стю максимуму пропущенн€ (20-30 мкм).Ќабором таких св≥тлоф≥льтр≥в постачений фотоколориметр-нефелометр ‘Ё -Ќ-57. ‘отоколориметри ‘Ё -ћ мають чотири широкосмугових св≥тлоф≥льтри з наступним д≥апазоном максимального пропущенн€ промен≥в у мкм:син≥й в≥д 400 до 480, зелений в≥д 500 до 560, жовтий в≥д 580 до 650, червоний в≥д 650 до 750. ѕри вибор≥ св≥тлоф≥льтра нер≥дко керуютьс€ забарвленн€м досл≥джуваного розчину. ќднак такий спос≥б не може претендувати на точн≥сть (табл. 1).
“аблиц€ 1






