ѕри визначенн≥ к≥лькост≥ розчиненого у вод≥ кисню використовують р€д х≥м≥чних реакц≥й, що посл≥довно переб≥гають. ƒо досл≥джуваноњ води додають хлорид марганцю ≥ луг, дл€ того, щоб одержати осад г≥дроксиду (II), €кий легко окислюЇтьс€:

√≥дроксид марганцю (II) окислюЇтьс€ розчиненим у вод≥ киснем у г≥дроксид (III):
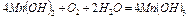
≥льк≥сть г≥дроксида марганцю (III), що утворивс€, визначаЇтьс€ вм≥стом розчиненого у вод≥ кисню. “аким чином, у результат≥ вище наведених реакц≥й, к≥льк≥сно вловлюЇтьс€ весь розчинений у вод≥ кисень.
ѕот≥м перевод€ть г≥дроксид марганцю (III) в екв≥валентну йому к≥льк≥сть йоду, легко ≥ точно зумовлену титруванн€м.
ƒл€ цього осад 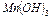 розчин€ють у сол€н≥й кислот≥. ”творюЇтьс€ хлорид марганцю (III), що легко розпадаЇтьс€ на хлорид марганцю (II) ≥ хлор:
розчин€ють у сол€н≥й кислот≥. ”творюЇтьс€ хлорид марганцю (III), що легко розпадаЇтьс€ на хлорид марганцю (II) ≥ хлор:


≥льк≥сть хлору, що утворив с€, екв≥валентна к≥лькост≥ хлориду марганцю (III), тобто к≥лькост≥ г≥дроксиду марганцю (III) ≥, в≥дпов≥дно, к≥лькост≥ розчиненого у вод≥ кисню. ’лор, що вид≥ливс€, визначають йодометрично: до досл≥джуваного розчину додають йодид кал≥ю: хлор вит≥сн€Ї з йодиду кал≥ю йод, €кий титрують розчином т≥осульфату натр≥ю у присутност≥ крохмалю:


–еактиви:
≥ндикатор Ц крохмаль
42,5%-й розчин хлориду марганцю (II) 
њдкий натр  або њдкий кал≥й
або њдкий кал≥й 
йодид кал≥ю  або йодид натр≥ю
або йодид натр≥ю 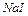
концентрована сол€на кислота
дистильована вода
0,01 н. розчин т≥осульфату натр≥ю 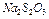
’≥д визначенн€. ” скл€нку Їмн≥стю 200-250 мл, наповнену доверху досл≥джуваною водою, внос€ть п≥петкою на дно посл≥довно 1 мл 42,5%-го розчину хлориду марганцю (II)  ≥ 1 мл сум≥ш≥ њдкого натру ≥ йодиду кал≥ю, що готують розчиненн€м 500 г NaOH або 700 г ќЌ ≥ 135 г Na≤ або 150 г KI у 1 л дистильованоњ води.
≥ 1 мл сум≥ш≥ њдкого натру ≥ йодиду кал≥ю, що готують розчиненн€м 500 г NaOH або 700 г ќЌ ≥ 135 г Na≤ або 150 г KI у 1 л дистильованоњ води.
—кл€нку обережно закривають пробкою ≥ к≥лька раз≥в ретельно збовтують. ¬≥дсто€ний осад розчин€ють додаванн€м 2-3 мл концентрованоњ сол€ноњ кислоти, пот≥м скл€нку знову збовтують ≥ вм≥ст њњ переливають у кон≥чну колбу, ретельно промиту дистильованою водою. …од, що вид≥ливс€, титрують приблизно 0,01 н. розчином т≥осульфату натр≥ю. ѕеред к≥нцем титруванн€ доливають у пробу 1 мл розчину крохмалю (≥ндикатор). ≥льк≥сть хлориду  розраховують за формулою:
розраховують за формулою:
 , мг/л,
, мг/л,
де  Ц обТЇм приблизно 0,01 н.
Ц обТЇм приблизно 0,01 н. 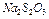 , що п≥шов на титруванн€;
, що п≥шов на титруванн€;
 Ц нормальн≥сть розчину т≥осульфату;
Ц нормальн≥сть розчину т≥осульфату;
 Ц Їмн≥сть скл€нки, мл;
Ц Їмн≥сть скл€нки, мл;
 Ц обТЇм реактив≥в, улитих у скл€нку з досл≥джуваною водою, мл;
Ц обТЇм реактив≥в, улитих у скл€нку з досл≥джуваною водою, мл;
8 Ц м≥л≥грам-екв≥валент кисню.
ѕитанн€:
1. ўо Ї головним джерелом надходженн€ кисню у поверхнев≥ води?
2. « €кими процесами звТ€зано споживанн€ кисню у вод≥?
3. ” €кому вигл€д≥ розчинений кисень знаходитьс€ у поверхневих водах?
4. який вм≥ст кисню у поверхневих водах?
5. ¬≥д чого залежить вм≥ст кисню у поверхневих водах?
6. яким методом визначаЇтьс€ вм≥ст розчиненого у вод≥ кисню?
7. « €кою метою визначаЇтьс€ к≥льк≥сть хлору, що утворивс€ у ход≥ досл≥дженн€, при визначенн≥ вм≥сту розчиненого у вод≥ кисню?
8. яка залежн≥сть м≥ж к≥льк≥стю хлору, що вид≥ливс€ у ход≥ реакц≥й, ≥ вм≥стом розчиненого у вод≥ кисню?
|
|
|
9. « €кою метою у досл≥дженн€х використовуЇтьс€ сол€на кислота?
10. ” €кою метою у досл≥дженн€х використовуЇтьс€ крохмаль?
Ћабораторна робота 6
¬»«Ќј„≈ЌЌя ќ »—Ћё¬јЌќ—“≤ ¬ќƒ»
ћетою лабораторноњ роботи Ї визначенн€ перманганатноњ окислюваност≥ води.
ќкислюван≥сть води Ц це умовна величина, що характеризуЇ забрудненн€ р≥зними речовинами, €к≥ легко окисл€ютьс€, головним чином, орган≥чного походженн€, а також що легко окисл€ютьс€ де€кими неорган≥чними дом≥шками ( ,
,  ,
,  ).
).
ƒл€ обчисленн€ окислюваност≥, що в≥дноситьс€ т≥льки до орган≥чних дом≥шок води, ввод€ть виправленн€ на окислюванн€ неорган≥чних речовин, що легко окисл€ютьс€. ќкремо визначають вм≥ст зал≥за ( ), сульф≥д≥в, н≥трат≥в. ѕот≥м, знаючи, що 1 мг
), сульф≥д≥в, н≥трат≥в. ѕот≥м, знаючи, що 1 мг  в≥дпов≥даЇ 0,14 мг кисню, робл€ть в≥дпов≥дн≥ перерахуванн€, в≥дн≥маючи з величини загальноњ окислюваност≥ к≥льк≥сть кисню, що окисл€Ї неорган≥чну дом≥шку.
в≥дпов≥даЇ 0,14 мг кисню, робл€ть в≥дпов≥дн≥ перерахуванн€, в≥дн≥маючи з величини загальноњ окислюваност≥ к≥льк≥сть кисню, що окисл€Ї неорган≥чну дом≥шку.
–озр≥зн€ють перманганатну окислюван≥сть ≥ д≥хроматну. ѕри визначенн≥ перманганатноњ окислюваност≥ окислювачем Ї перманганат кал≥ю  у кислому середовищ≥. ќднак в≥н не окислюЇ вс≥ дом≥шки води. —туп≥нь окислюванн€ перманганатом кал≥ю залежить в≥д х≥м≥чноњ природи речовин, що окисл€ютьс€, ≥ може коливатис€ у широких межах. ѕерманганатна окислюван≥сть Ї дуже гарною характеристикою питних вод, а також вод р≥к, захищених в≥д вилученн€ будь-€ких промислових в≥дход≥в. ѕри забрудненн≥ вод промисловими стоками перманганатна окислюван≥сть не в≥дбиваЇ повного вм≥сту орган≥чних забруднень у вод≥. ” цьому випадку визначають д≥хроматну окислюван≥сть Ц вм≥ст ус≥х орган≥чних речовин у вод≥, у тому числ≥ ≥ важкоокислюваних. “ому д≥хроматна окислюван≥сть називаЇтьс€ ще х≥м≥чним споживанн€м кисню (’— ) ≥ Ї найважлив≥шим показником €кост≥ води. ƒл€ њњ характеристики визначають б≥ох≥м≥чне споживанн€ кисню (Ѕ— ).
у кислому середовищ≥. ќднак в≥н не окислюЇ вс≥ дом≥шки води. —туп≥нь окислюванн€ перманганатом кал≥ю залежить в≥д х≥м≥чноњ природи речовин, що окисл€ютьс€, ≥ може коливатис€ у широких межах. ѕерманганатна окислюван≥сть Ї дуже гарною характеристикою питних вод, а також вод р≥к, захищених в≥д вилученн€ будь-€ких промислових в≥дход≥в. ѕри забрудненн≥ вод промисловими стоками перманганатна окислюван≥сть не в≥дбиваЇ повного вм≥сту орган≥чних забруднень у вод≥. ” цьому випадку визначають д≥хроматну окислюван≥сть Ц вм≥ст ус≥х орган≥чних речовин у вод≥, у тому числ≥ ≥ важкоокислюваних. “ому д≥хроматна окислюван≥сть називаЇтьс€ ще х≥м≥чним споживанн€м кисню (’— ) ≥ Ї найважлив≥шим показником €кост≥ води. ƒл€ њњ характеристики визначають б≥ох≥м≥чне споживанн€ кисню (Ѕ— ).
Ѕ≥ох≥м≥чним споживанн€м кисню називаЇтьс€ к≥льк≥сть кисню, витрачена у визначений пром≥жок часу на аеробний б≥ох≥м≥чний розклад орган≥чних речовин, що утримуютьс€ у досл≥джуван≥й вод≥.
¬изначенн€ перманганатноњ окислюваност≥ води у кислому середовищ≥. ќкислюван≥сть визначають окислюванн€м дом≥шок досл≥джуваноњ води перманганатом кал≥ю.
ѕерманганат кал≥ю, будучи сильним окислювачем, реагуЇ з присутн≥ми у вод≥ в≥дновниками. ћарганець зм≥нюЇ при цьому св≥й ступ≥нь окислюванн€ з +7 до +2 (в≥дновлюЇтьс€). –еакц≥€ переб≥гаЇ у кислому середовищ≥:

Ќадлишок перманганату кал≥ю реагуЇ з щавлевою кислотою, що вводитьс€ у розчин:

або

ўавлева кислота, що не вступила у реакц≥ю, в≥дтитровуЇтьс€ перманганатом кал≥ю.
ќкислюван≥сть можна визначити при нагр≥ванн≥ ≥ на холод≥.
«вичайно у практиц≥ водопостачанн€ окислюван≥сть визначають при нагр≥ванн≥.
–еактиви:
концентрована с≥рчана кислота
0,01 н. розчин перманганату кал≥ю 
0,01 н. розчин щавлевоњ кислоти 
дистильована вода
’≥д визначенн€. 100 мл досл≥джуваноњ води п≥петкою наливають у кон≥чну колбу Їмн≥стю 250 мл, додають 5 мл розчину с≥рчаноњ кислоти (1:3), доливають точно 10 мл приблизно 0,01 н. розчину перманганату кал≥ю ≥, накривши колбу годинниковим склом або л≥йкою, нагр≥вають р≥дину до кип≥нн€ ≥ кип'€т€ть прот€гом 10 хвилин. „ас кип'€т≥нн€ повинен дотримуватис€ точно, тому що тривал≥сть нагр≥ванн€ води з перманганатом кал≥ю сильно позначаЇтьс€ на його д≥њ, що окислюЇ.
|
|
|
„астина доданого перманганату кал≥ю витрачаЇтьс€ при кип'€т≥нн≥ на окислюванн€ орган≥чних дом≥шок води. ол≥р розчину стаЇ б≥льш св≥тлим. ѕот≥м зн≥мають колбу з нагр≥вального приладу, внос€ть у нењ 10 мл 0,01 н. розчину щавлевоњ кислоти ≥ добре збовтують. –озчин знебарвлюЇтьс€ за рахунок того, що щавлева кислота вступаЇ у реакц≥ю з надлишком перманганату, €кий залишивс€ п≥сл€ окислюванн€ орган≥чних дом≥шок води. «небарвлений гар€чий розчин титрують приблизно 0,01 н. розчином перманганату кал≥ю до по€ви св≥тло-рожевого забарвленн€.
“аким чином, перманганат кал≥ю додають до досл≥джуваноњ води 2 рази (на початку досл≥дженн€ вводитьс€ 10 мл розчину ≥ наприк≥нц≥ досл≥дженн€ при титруванн≥). ÷е загальна к≥льк≥сть перманганату кал≥ю витрачаЇтьс€ на окислюванн€ орган≥чних дом≥шок води ≥ на 10 мл 0,01 н. розчину щавлевоњ кислоти.
ѕри визначенн≥ окислюваност≥ треба враховувати витрату перманганату кал≥ю на окислюванн€ т≥льки орган≥чних дом≥шок води. “ому окремим досл≥дженн€м необх≥дно встановити к≥льк≥сть перманганату кал≥ю, що йде на окислюванн€ 10 мл щавлевоњ кислоти. ƒл€ цього нагр≥вають до кип≥нн€ 100 мл дистильованоњ води, п≥дкисленоњ 5 мл с≥рчаноњ кислоти (1:3), зн≥мають колбу з нагр≥вального приладу, додають 10 мл 0,01 н. розчину щавлевоњ кислоти ≥ титрують до св≥тло-рожевого забарвленн€ розчином перманганату кал≥ю.
ѕроведене визначенн€ даЇ можлив≥сть перев≥рити нормальн≥сть розчину перманганату кал≥ю. Ќеобх≥дн≥сть такоњ перев≥рки при кожному визначенн≥ окислюваности по€снюЇтьс€ тим, що 0,01 н. розчин перманганату кал≥ю не ст≥йкий ≥ концентрац≥€ його зм≥нюЇтьс€.
ѕри розрахунку нормальност≥ розчину виход€ть з наступних м≥ркувань. якщо нормальн≥сть  Ц число м≥л≥грам-екв≥валент≥в речовини у 1 мл ≥
Ц число м≥л≥грам-екв≥валент≥в речовини у 1 мл ≥  Ц обТЇм розчину у м≥л≥грамах, то добуток
Ц обТЇм розчину у м≥л≥грамах, то добуток  Ц це число м≥л≥грам-екв≥валент≥в речовин у
Ц це число м≥л≥грам-екв≥валент≥в речовин у  мл обТЇму.
мл обТЇму.
„исло м≥л≥грам-екв≥валент≥в щавлевоњ кислоти в 10 мл 0,01 н. розчину, вз€тих дл€ визначенн€, дор≥внюЇ числу м≥л≥грам-екв≥валент≥в перманганату кал≥ю, що прореагував з нею.
ќтже:
 ,
,
зв≥дки
 ,
,
де  Ц обТЇм розчину перманганату кал≥ю, витрачений на титруванн€ 10 мл 0,01 н. розчину щавлевоњ кислоти. ѕерманганатну окислюван≥сть води
Ц обТЇм розчину перманганату кал≥ю, витрачений на титруванн€ 10 мл 0,01 н. розчину щавлевоњ кислоти. ѕерманганатну окислюван≥сть води  розраховують за формулою:
розраховують за формулою:
 , мг/л
, мг/л
де  Ц загальний обТЇм 0,01 н. розчину перманганату кал≥ю, доданий у пробу при визначенн≥, мл;
Ц загальний обТЇм 0,01 н. розчину перманганату кал≥ю, доданий у пробу при визначенн≥, мл;
 Ц обТЇм 0,01 н. розчину перманганату кал≥ю, витрачений на окислюванн€ 10 мл 0,01 н. розчину щавлевоњ кислоти, мл;
Ц обТЇм 0,01 н. розчину перманганату кал≥ю, витрачений на окислюванн€ 10 мл 0,01 н. розчину щавлевоњ кислоти, мл;
 Ц нормальн≥сть розчину перманганату кал≥ю;
Ц нормальн≥сть розчину перманганату кал≥ю;
8 Ц м≥л≥грам-екв≥валент кисню;
 Ц обТЇм досл≥джуваноњ води, вз€тоњ дл€ визначенн€, мл.
Ц обТЇм досл≥джуваноњ води, вз€тоњ дл€ визначенн€, мл.
ѕитанн€:
1. ƒайте визначенн€ окислюваност≥ води.
2. як розр≥зн€ють окислюван≥сть води?
3. яка окислюван≥сть Ї характеристикою води дл€ господарсько-питного водопостачанн€?
4. яка окислюван≥сть Ї характеристикою промислових ст≥чних вод?
5. ўо таке х≥м≥чне споживанн€ кисню?
6. ўо таке б≥ох≥м≥чне споживанн€ кисню?
7. «а допомогою €коњ речовини визначають перманганатну окислюван≥сть води?
8. ѕри €ких температурах можна визначати окислюван≥сть води?
9. «вичайно у практиц≥ водопостачанн€ окислюван≥сть води визначають при нагр≥ванн≥ чи на холод≥?
10. яку окислюван≥сть води визначали на лабораторн≥й робот≥?
11. « €кою метою у досл≥дженн€х перев≥р€ють нормальн≥сть розчину перманганату кал≥ю?
12. « €кою метою у лабораторних досл≥дженн€х встановлюють к≥льк≥сть перманганату кал≥ю, що йде на окислюванн€ певноњ к≥лькост≥ щавлевоњ кислоти?
Ћабораторна робота 7
¬»«Ќј„≈ЌЌя ’Ћќ–»ƒ≤¬ ” ¬ќƒј’
ћетою лабораторноњ роботи Ї визначенн€ вм≥сту хлорид-≥он≥в у вод≥.
” поверхнев≥ води хлориди надход€ть з магматичних пор≥д, до складу €ких вход€ть м≥нерали, що м≥ст€ть хлор (садал≥т, хлорапат≥т та ≥н.) ≥з соленосних в≥дкладень (гал≥т). «начн≥ к≥лькост≥ хлорид≥в надход€ть у воду у результат≥ обм≥ну з океаном через атмосферу внасл≥док вимиванн€ водами хлорид≥в ≥з ірунт≥в, особливо засолених, багато хлорид≥в надходить у водойми з промисловими ≥ побутовими ст≥чними водами.
|
|
|
Ќа в≥дм≥ну в≥д сульфатних ≥ карбонатних ≥он≥в хлориди не схильн≥ до створенн€ асоц≥йованих пар.
« ус≥х ан≥он≥в хлориди волод≥ють найб≥льшою м≥грац≥йною здатн≥стю, що по€снюЇтьс€ њх гарною розчинн≥стю, слабко вираженою здатн≥стю до сорбц≥њ на суспенз≥€х.
” р≥чкових водах ≥ водах пр≥сних озер вм≥ст хлорид≥в коливаЇтьс€ в≥д часток м≥л≥грам≥в до дес€тк≥в, сотень, а ≥нод≥ тис€ч м≥л≥грам≥в на л≥тр. ” морських ≥ п≥дземних водах вм≥ст хлорид≥в значно вище Ц аж до пересичених розчин≥в ≥ розсол≥в.
’лориди Ї переважним ан≥оном у високом≥нерал≥зованих водах.
ѕ≥двищен≥ вм≥сти хлорид≥в пог≥ршують смаков≥ €кост≥ води ≥ робл€ть њњ малопридатною дл€ питного водопостачанн€ й обмежують застосуванн€ дл€ багатьох техн≥чних ≥ господарських ц≥лей, а також дл€ зрошенн€ с≥льськогосподарських уг≥дь.
«нанн€ вм≥сту ≥ поводженн€ хлорид≥в у водах необх≥дно при р≥шенн≥ р€ду проблем, таких €к питанн€ њхньоњ круговерт≥ у природ≥ ≥ процеси солезбору. ¬≥домост≥ про вм≥ст хлорид≥в у п≥дземних водах часто використовуютьс€ при г≥дрох≥м≥чних пошуках нафтових, газових ≥ рудних родовищ (зал≥за, свинцю, м≥д≥, цинку, кадм≥ю, урану).
¬м≥ст хлорид≥в у питн≥й вод≥ не повинен перевищувати 300 мг/л: велик≥ к≥лькост≥ хлорид≥в додають вод≥ г≥рко-солоний смак.
≤они 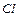 , що м≥ст€тьс€ в вод≥, визначають титруванн€м розчину н≥трату ср≥бла у присутност≥ ≥ндикатора хромату кал≥ю або потенц≥ометричним титруванн€м. ѕри цьому у розчин≥ можуть одночасно переб≥гати дв≥ реакц≥њ:
, що м≥ст€тьс€ в вод≥, визначають титруванн€м розчину н≥трату ср≥бла у присутност≥ ≥ндикатора хромату кал≥ю або потенц≥ометричним титруванн€м. ѕри цьому у розчин≥ можуть одночасно переб≥гати дв≥ реакц≥њ:

або


осад цегельно-
червоного кольору
або
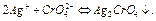
якщо одночасно можливий переб≥г двох реакц≥й з утворенн€м осад≥в, то спочатку в≥дбуваЇтьс€ випаданн€ менш розчинного б≥лого осаду  . –озчин маЇ у продовж цього часу жовте забарвленн€ в≥д присутн≥х у ньому ≥он≥в
. –озчин маЇ у продовж цього часу жовте забарвленн€ в≥д присутн≥х у ньому ≥он≥в  . “≥льки п≥сл€ того, €к зак≥нчуЇтьс€ випад≥нн€ осаду
. “≥льки п≥сл€ того, €к зак≥нчуЇтьс€ випад≥нн€ осаду  , починаЇ утворюватис€ б≥льш розчинний цегл€но-червоний осад
, починаЇ утворюватис€ б≥льш розчинний цегл€но-червоний осад  , що св≥дчить про дос€гненн€ екв≥валентноњ точки.
, що св≥дчить про дос€гненн€ екв≥валентноњ точки.
“ому к≥нець реакц≥њ зв'€зуванн€ хлорид-≥она у малорозчинний хлорид ср≥бла визначаЇтьс€ по по€в≥ цегл€но-червоного забарвленн€ розчину у насл≥дку випад≥нн€ осаду хромата ср≥бла.
–еактиви:
10%-й розчин хромату кал≥ю 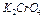
1 н. або 0,1 н. розчин н≥трату ср≥бла
’≥д визначенн€. 100 мл досл≥джуваноњ води в≥дбирають п≥петкою у кон≥чну колбу на 250 мл, доливають 1 мл 10%-го розчину хромату кал≥ю ≥ титрують розчином н≥трату ср≥бла до по€ви цегл€но-червоного забарвленн€. ¬≥дзначають обТЇм розчину н≥трату ср≥бла, витрачений на титруванн€.
≥льк≥сть хлорид-≥она  у досл≥джуван≥й вод≥ розраховують за формулою:
у досл≥джуван≥й вод≥ розраховують за формулою:
 мг/л
мг/л
де  Ц обТЇм розчину н≥трату ср≥бла, що п≥шов на титруванн€, мл;
Ц обТЇм розчину н≥трату ср≥бла, що п≥шов на титруванн€, мл;
 Ц нормальн≥сть розчину н≥трату ср≥бла;
Ц нормальн≥сть розчину н≥трату ср≥бла;
 Ц м≥л≥грам-екв≥валент хлору (35,5);
Ц м≥л≥грам-екв≥валент хлору (35,5);
 Ц обТЇм досл≥джуваноњ води, уз€тоњ дл€ титруванн€, мл.
Ц обТЇм досл≥джуваноњ води, уз€тоњ дл€ титруванн€, мл.
ѕитанн€:
1. ” поверхнев≥ води зв≥дки потрапл€ють хлориди?
2. якими методами можливо визначенн€ к≥лькост≥ хлорид-≥он≥в у вод≥?
3. який вм≥ст хлорид≥в у вод≥, призначен≥й дл€ господарсько-питного водопостачанн€, зг≥дно √ќ—“ 2874-82?
4. Ќазв≥ть реакц≥њ, €к≥ переб≥гають у ход≥ виконанн€ лабораторноњ роботи.
5. Ќазв≥ть речовини, що утворюють осади.
6. Ќазв≥ть ≥ндикатор, €кий використовуЇтьс€ у дан≥й лабораторн≥й робот≥.
7. як впливаЇ п≥двищений вм≥ст хлорид≥в на €к≥сть води?
8. як називаЇтьс€ вода з п≥двищеним вм≥стом хлорид≥в?
9. ƒе використовуЇтьс€ вода з п≥двищеним вм≥стом сульфат≥в, хлорид≥в?
Ћабораторна робота 8
¬»«Ќј„≈ЌЌя ¬ћ≤—“” —”Ћ№‘ј“-≤ќЌ≤¬ ” ¬ќƒ≤
ћетою лабораторноњ роботи Ї визначенн€ вм≥сту сульфат-≥он≥в у вод≥.
¬м≥ст сульфат≥в у питн≥й вод≥ за √ќ—“ 2874-82 не повинен перевищувати 500 мл/г. ѕ≥двищена к≥льк≥сть сульфат≥в у вод≥ небажана, тому що приводить до пог≥ршенн€ органолептичних показник≥в води ≥ зб≥льшенню њњ агресивност≥. ¬м≥ст ≥он≥в  у вод≥ визначають комплексометричним методом Ц за допомогою трилона Ѕ. “рилон Ѕ утворюЇ комплекси з ≥онами
у вод≥ визначають комплексометричним методом Ц за допомогою трилона Ѕ. “рилон Ѕ утворюЇ комплекси з ≥онами  . —утн≥сть комплексометричного методу визначенн€ ≥он≥в
. —утн≥сть комплексометричного методу визначенн€ ≥он≥в  пол€гаЇ у тому, що в досл≥джувану воду ввод€ть ≥они
пол€гаЇ у тому, що в досл≥джувану воду ввод€ть ≥они  (розчин
(розчин 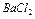 ), що зв'€зують ≥они
), що зв'€зують ≥они  в осад:
в осад:
|
|
|

≥льк≥сть сульфат≥в оц≥нюють за р≥зницею витрати трилона Ѕ на ≥они  до осадженн€ ≥он≥в
до осадженн€ ≥он≥в  ≥ п≥сл€ њхнього осадженн€. ќск≥льки у досл≥джуван≥й вод≥ присутн≥ ≥они
≥ п≥сл€ њхнього осадженн€. ќск≥льки у досл≥джуван≥й вод≥ присутн≥ ≥они  ≥
≥  , то необх≥дно ввести в≥дпов≥дн≥ виправленн€ на ц≥ ≥они.
, то необх≥дно ввести в≥дпов≥дн≥ виправленн€ на ц≥ ≥они.
–еактиви:
≤ндикатори: метиловий червоний, ер≥охром чорний (≈’„-“)
0,1 н. розчин сол€ноњ кислоти
рзчин хлориду бар≥ю 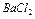
ам≥ачний буферний розчин 
0,05 н. розчин трилону Ѕ
0,1 н. розчин њдкого натру
’≥д визначенн€. ” кон≥чну колбу Їмн≥стю 250 мл наливають п≥петкою 50 мл досл≥джуваноњ води, додають 1-2 крапл≥ розчину ≥ндикатора метилового червоного ≥ п≥дкислюють 0,1 н. розчином сол€ноњ кислоти. ѕот≥м цей розчин кип'€т€ть 3-5 хв дл€ видаленн€ вуглекислоти. ƒо кипл€чого розчину додають точно 1 мл розчину хлориду бар≥ю, що м≥стить ≥они магн≥ю (10 г  ≥ 4 г
≥ 4 г  у 1 л), ≥ знову кип'€т€ть 10-15 с. ѕрисутн≥сть у розчин≥ ≥он≥в
у 1 л), ≥ знову кип'€т€ть 10-15 с. ѕрисутн≥сть у розчин≥ ≥он≥в  необх≥дна дл€ б≥льш ч≥ткого визначенн€ к≥нц€ титруванн€ трилоном Ѕ.
необх≥дна дл€ б≥льш ч≥ткого визначенн€ к≥нц€ титруванн€ трилоном Ѕ.
„астина ≥он≥в  витрачаЇтьс€ на зв'€зуванн€ ≥он≥в
витрачаЇтьс€ на зв'€зуванн€ ≥он≥в  у сульфат≥ бар≥ю, а частина залишаЇтьс€. „ерез 10-15 хв досл≥джувану воду нейтрал≥зують 0,1 н. розчином њдкого натру, додають його обережно по крапл€м (до переходу червоного забарвленн€ розчину в жовте). ѕот≥м увод€ть 5 мл ам≥ачного буферного розчину, дек≥лька крапель ≥ндикатора ≈’„-“ ≥ титрують 0,05 н. розчином трилону Ѕ (
у сульфат≥ бар≥ю, а частина залишаЇтьс€. „ерез 10-15 хв досл≥джувану воду нейтрал≥зують 0,1 н. розчином њдкого натру, додають його обережно по крапл€м (до переходу червоного забарвленн€ розчину в жовте). ѕот≥м увод€ть 5 мл ам≥ачного буферного розчину, дек≥лька крапель ≥ндикатора ≈’„-“ ≥ титрують 0,05 н. розчином трилону Ѕ ( ).
).
¬ окрем≥й проб≥ визначають обТЇм розчину трилону Ѕ ( ),необх≥дний дл€
),необх≥дний дл€  . ¬ ≥нш≥й окрем≥й проб≥ досл≥джуваноњ води (50 мл) визначають обТЇм розчину трилону Ѕ (
. ¬ ≥нш≥й окрем≥й проб≥ досл≥джуваноњ води (50 мл) визначають обТЇм розчину трилону Ѕ ( ), необх≥дний дл€ титруванн€ ≥он≥в
), необх≥дний дл€ титруванн€ ≥он≥в  ,
,  . ¬м≥ст ≥он≥в
. ¬м≥ст ≥он≥в  (
( ) обчислюють за формулою:
) обчислюють за формулою:
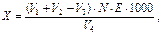 мг/л,
мг/л,
де  Ц нормальн≥сть розчину трилона Ѕ;
Ц нормальн≥сть розчину трилона Ѕ;
 Ц м≥л≥грам-екв≥валент ≥она SO42- (48);
Ц м≥л≥грам-екв≥валент ≥она SO42- (48);
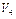 Ц обТЇм досл≥джуваноњ води (50 мл).
Ц обТЇм досл≥джуваноњ води (50 мл).
–езультати анал≥зу записують у таблицю.
| ћ≥сце добору води | ¬м≥ст хлорид-≥он≥в | ¬м≥ст сульфат-≥он≥в | ||
| мг/л | мг-екв/л | мг/л | мг-екв/л | |
ѕитанн€:
1. який вм≥ст сульфат≥в у вод≥, призначен≥й дл€ господарсько-питного водопостачанн€, зг≥дно √ќ—“ 2874-82?
2. ƒо чого призводить п≥двищений вм≥ст сульфат≥в у вод≥?
3. якими методами можливо визначенн€ к≥лькост≥ сульфат≥в у вод≥?
4. „ому використовуЇтьс€ хлорид бар≥ю дл€ визначенн€ сульфат≥в у вод≥, а не €кась ≥нша речовина?
5. яким методом визначаЇтьс€ вм≥ст сульфат≥в у дан≥й лабораторн≥й робот≥?
6. —утн≥сть даного метода визначенн€ сульфат≥в у вод≥?
7. Ќазв≥ть ≥ндикатори, €к≥ використовуЇтьс€ у дан≥й лабораторн≥й робот≥.
8. як впливаЇ п≥двищений вм≥ст сульфат≥в на €к≥сть води?
9. як називаЇтьс€ вода з п≥двищеним вм≥стом сульфат≥в, хлорид≥в?
10. ƒе використовуЇтьс€ вода з п≥двищеним вм≥стом сульфат≥в, хлорид≥в?
Ћабораторна робота 9






