1. Напишіть формулу міцели, утвореної взаємодією розчину CaCl2 з надлишком розчину Na2SO4 і вкажіть складові частини міцели.
2. Який об’єм 0,1н K2SO4 (в мл) потрібно добавити до 1л золя Fe(OH)3, щоб викликати його коагуляцію? Поріг коагуляції 0,50 ммоль/л.
3. У дві колби налито по 100 мл золя Al(OH)3. Щоб викликати явну коагуляцію. потрібно добавити: у першу колбу – 10,5 мл 1н KCl, а у другу – 12,3 0,001н Na3PO4. Обчисліть пороги коагуляції і визначіть заряд частинок золя.
ХІД РОБОТИ
Для визначення наближеного значення порогу коагуляції готують послідовним розведенням розчини електролітів (KCl, CaCl2, AlCl3) таких концентрацій 1, 10-1, 10-2, 10-3, 10-4, 10-5 моль/л.
Розчини готують таким чином. У першу пробірку з бюретки набирають 20 мл вихідного (1 моль/л) розчину відповідного електроліту. Із цього розчину піпеткою відбирають 2 мл розчину, переносять його у другу пробірку, добавляють до нього 18 мл води і перемішують. Потім з другої 2 мл розчину переносять у третю і т.д., поки не приготують розчини шести концентрацій. Таким чином, одержують 18 мл кожного розчину електроліту, а в останній пробірці – 20 мл. Після чого, починаючи із пробірки з найменшою концентрацією електроліту, відбирають по 5 мл піпеткою у чисті пробірки і до них з бюретки добавляють по 5 мл колоїдного розчину і перемішують. Через деякий час (10-15 хв) визначають візуально, у якій пробірці відбулася коагуляція. Результати спостережень записують таблицю. При цьому наявність коагуляції відмічають знаком „+”, а відсутність „ – ”.
Пороги коагуляції електролітів (моль/л)
| Електроліт | Грубий поріг коагуляції, моль/л | Точний поріг коагуляції моль/л | ||||||||
10 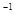
| 10 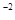
| 10 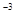
| 10 
| 10 
| 0,8 | 0,6 | 0,4 | 0,2 | ||
| КСl | ||||||||||
CaCl 
| ||||||||||
AlCl 
|
Таким чином визначають дві сусідні концентрації електроліту, при одній з яких коагуляція ще замітна, а при іншій – не замітна, тобто знаходять верхню і нижню границю коагуляції (грубий поріг коагуляції).
Потім визначають точний поріг коагуляції, що лежить між верхньою і нижньою границею грубого порогу коагуляції. Для цього із розчину, що залишився в перших пробірках (13мл), відбирають піпеткою у чотири пробірки 4, 3, 2, 1 мл і добавляють із бюретки відповідно 1, 2, 3 і 4 мл води (щоб у кожній пробірці було по 5мл) і приливають із бюретки по 5мл колоїдного розчину, перемішуючи, і залишають на 10-15 хв. Після цього теж відмічають коагуляцію в цих пробірках і результати записують у таблицю. Обчислюють точний поріг коагуляції як середню концентрацію електроліту, як і в випадку з визначенням грубого порогу коагуляції. При цьому слід врахувати розведення вдвічі розчину електроліту колоїдним розчином.
Одержавши значення точного порогу коагуляції для всіх електролітів, виводять правило значності, для чого знайдені значення порогів коагуляції ділять на найменший поріг коагуляції (AlCl3). Порівнюють експериментальне відношення порогів коагуляції з теоретично вичисленим за правилом Дерягіна-Ландау:

- де 1, 2, 3 – заряд йона-коагулятора.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
1. Написати формулу міцел золей: Mg3(PO4)2, стабілізованого MgCl2, і SiO2, стабілізованого K2SiO3. Для якого з вказаних золей кращим коагулятором є розчин FeCl3, а для якого – Na2SO4?
2. Розрахуйте поріг коагуляції золю (γ), якщо до 5мл золя ферум(ІІІ) гідроксиду додали 2мл води і явна коагуляція наступила при додаванні 3мл 0,01 М розчину K2SO4.
3. Пороги коагуляції деякого гідрозолю рівні
γ(СаСl2) = 0,3 ммоль/л, Сп(K2SO4) = 0,0299 моль/л. Який по знаку заряд несуть частинки золю?
4. Написати формулу міцел золів: Cu(OH)2, стабілізованого CuCl2, і ZnS, стабілізованого Na2S. Для якого з вказаних золей кращим коагулятором є розчин FeCl3, а для якого – Na2SO4?
5. Які йони електролітів – Na2SO4 чи K4[Fe(CN)6], є коагулюючими для гідрозолю ферум(ІІІ) гідгоксиду, одержаного методом гідролізу.
6. Коагулююча роль якого із електролітів – Na2SO4 чи MgCl2 буде сильніша при дії на золь аргентум йодиду, одержаного змішуванням рівних об’ємів AgNO3 з с=0,01моль/дм3 і KI з с= 0,015 моль/дм3.
7. Написати формулу міцел золів: BaSO4, стабілізованого Ba(NO3)2 і BaSO4,стабілізованого K2SO4. Для якого з вказаних золей кращим коагулятором є розчин FeCl3, а для якого – Na2SO4?
8. Визначте знак заряду частинок золю, якщо при коагуляції його електролітами одержані такі пороги коагуляції в ммоль/дм3: γ(MqСl2)=300, γ(KNO3)=320, γ(Na3PO4)=0,6.
9. Який мінімальний об’єм K2Cr2O7 з сЕ=0,01 моль/дм3 необхідно для коагуляції 1 дм3 золю ферум(ІІІ) гідроксиду, одержаного методом гідролізу. Поріг коагуляції
0,06 ммоль/дм3.
10. Написати формулу міцел золів: Zn(OH)2, стабілізованого ZnCl2,і As2S3 стабілізованого H2S. Для якого з вказаних золей кращим коагулятором є розчин FeCl3, а для якого – Na2SO4?
11. Коагуляція негативного золю As2S3 відбувається під дією КNO3, MgCl2, AlCl3, пороги коагуляції яких рівні 50,0; 0,72; 0,93 ммоль/дм3. Як співвідносяться між собою коагулюючі здатності катіонів різної валентності.
12. У дві колби налито по 50 мл золю Fe(OH)3. Для коагуляції довелось добавити в першу колбу 5,30 мл 1 М КСl, а у другу 31,5 мл 0,005 М Na2SO4. Обчисліть пороги коагуляції електролітів і визначте знак заряду золю.
13. Написати формулу міцел золів: Fe(OH)3, стабілізованого FeCl3, і CaCO3, стабілізованого Na2CO3. Для якого з вказаних золей кращим коагулятором є розчин AlCl3, а для якого – Na2SO4?
14. Який об’єм 0,001 М K2Cr2O7 (в см3) потрібно додати до
1 см3 золю Al(OH)3, щоб викликати його коагуляцію? Поріг коагуляції 0,63 ммоль/дм3.
15. Написати формулу міцел золів: Al(OH)3, стабілізованого AlCl3, і SiO2, стабілізованого H2SiO3. Для якого з вказаних золей кращим коагулятором є розчин FeCl3, а для якого – Na2SO4?
22 ОРГАНІЧНІ СПОЛУКИ
(лабораторна робота)
Програмні питання
1. Класифікація та номенклатура органічних сполук. Ізомерія.
2. Насичені (алкани) та ненасичені (алкени, алкіни) вуглеводні. Поняття про гомологічний ряд. Способи одержання та їх хімічні властивості. Циклоалкани (нафтени), характерні реакції.
3. Ароматичні вуглеводні. Бензен та його гомологи. Характерні реакції та реакційна здатність.
4. Взаємні перетворення галогенопохідних та спиртів. Феноли.
5. Кисневмісні органічні сполуки (альдегіди, кетони, карбонові кислоти). Характерні реакції та їх властивості.
6. Поняття про високомолекулярні та гетероциклічні сполуки.
Література
[25], [26]






