1. Другий закон термодинаміки (перший закон термодинаміки, ентропія і її властивості, вільна енергія Гіббса тощо).
2. При утворенні 8,10 г купрум(ІІ) хлориду із простих речовин (Cu i Cl2) виділяється 13,4 кДж тепла. Обчислити ентальпію утворення CuCl2.
(Варіанти: а) Визначити зміну ентропії 5,85г NaCl при нагріванні від 25 ºС до 820 ºС, якщо температура його плавлення (tпл) 800 ºС, молярна теплоємність до Тпл становить 50,66 кДж/моль·К, а вище Тпл - Ср = 66,46 кДж/моль·К. Теплота плавлення 30,18 кДж/моль; б) Ентальпія згоряння метанолу становить - 722 кДж/моль. Визначіть ентальпію його утворення, якщо 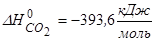 ,
,  )
)
3. Для реакції: CaCO3(к) = CaO(к) + CO2(г), користуючись даними довідника:
- обчисліть ∆Нº і ∆Sº хімічної реакції;
- зробіть висновок про термодинамічну можливість чи неможливість цієї реакції за стандартних умов і при 2000К;
- визначіть рівноважну температуру цього процесу.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
Завдання І
Для наведених рівнянь реакцій визначіть двома способами стандартну енергію Гіббса реакції. Ця реакція екзо- чи ендотермічна? Чи може відбуватись ця реакція при стандартних умовах?
| В | Рівняння реакції |
| CO2(г) + H2 (г) = CO(г) + H2O(г) | |
| CO2(г) + 4 H2 (г) = CH4 (г) + 2 H2O (p) | |
| 4 NH3(г) + 3 O2(г) = 2N2(г) + 6H2O(p) | |
| 4 NH3(г) + 5 O2(г) = 4NO(г) + 6H2O | |
| 2SO2(г) + O2(г) = 2SO3(г) | |
| 2H2S(г) + 3 O2(г) = 2SO2(г) + 2H2O(г) | |
| CH4(г) + H2O(г) = CO(г) + 3H2(г) | |
| C2H5OH(p) = C2H4(г) + H2O(г) | |
| 2CO2(г) + 2 H2O(г) = C2H4(г) + 3O2(г) | |
| Ca(OH)2(k) + CO2(г) = CaCO3(k) + H2O(p) | |
| 2KCl(k) + 3O2(г) = 2KClO3(k) | |
| NH4NO3(k) = N2O(г) + 2H2O(г) | |
| 2SnO2(k) = 2SnO(k) + O2(г) | |
| 4FeO(k) + O2(г) = 2Fe2O3(k) | |
| Fe3O4(k) + H2(г) = 3FeO(k) + H2O(г) |
Завдання ІІ
В-1. Під час відновлення 19,88 г купрум(II) оксиду воднем до купрум(І) оксиду виділяється 12,63 кДж.
Визначте ентальпію утворення Сu2О(к), якщо:
∆Н°утв. (СuO) = -156 кДж/моль,
∆Н° утв. (Н2О) = -286 кДж/моль.
В-2. Визначіть ступінь розкладу СаСО3, якщо при термічному розкладі його наважки масою 20 г затрачається 30 кДж тепла.
∆Н0утв. (СаO) = -635 кДж/моль;
∆Н0утв. (СаСO3) = -1206 кДж/моль;
∆Н0утв. (СO2) = -393,5кДж/моль.
В-3. Яка кількість тепла виділиться внаслідок згоряння
336 дм3 водяного газу (суміш однакових об'ємів Н2 і СО), взятого за нормальних умов?
(∆Н0утв. (Н2О) = -286 кДж/моль;
∆Н0утв. (СО) = -110,6 кДж/моль;
∆Н0утв. (СО2) = -393,8 кДж/моль).
В-4. Визначте ∆G°298 реакції:
3 NiО(к) + 2А1(к) = 3 Nі(к) + А12О3(к)
∆Gº298 (NiO) = -211,6 кДж/моль,
∆Gº298 (А12О3) = -1583,3 кДж/моль.
В-5. Реакція між хлором і йодоводнем відбувається за рівнянням:
С12 + 2НІ = І2 + 2НС1
Якщо в реакції використано 1 л С12 (за н.у.), то виділяється 10,47 кДж тепла. Обчисліть тепловий ефект реакції.
В-6. Визначте зміну ентропії внаслідок плавлення 31,77 г міді. Температура плавлення міді дорівнює 1083 °С, теплота плавлення - 10 кДж/моль.
В-7. Визначте ∆Gº298 реакції:
2КС1О3(к) = 2 КС1(к) + 3 О2(г)
∆Н°утв.(КСlO3)= -391,2 кДж/моль; Sº(КСlO3)=143,0 Дж/моль·К; ∆Н°утв. (KCl)= -435,9 кДж/моль; Sº(KC1)=82,6 Дж/моль·К;
Sº(O2) = 205,0 Дж/моль·К.
В-8. Реакція горіння метану відбувається за рівнянням:
СН4 + 2О2 = СО2 + 2 Н2О; ∆Н = -891,3 кДж.
Скільки тепла виділиться при згорянні 100 л метану за н.у.?
В-9. Визначте ∆G°298 реакції і покажіть, в якому напрямку можливий їхній перебіг за стандартних умов.
СаСО3(к) = СаО(к) + СО2(г),
∆Нºутв.(CaCO3)= -1207,7кДж/моль; Sº(CaCO3)=91,6Дж/моль·К;
∆Нºутв.(СаО)= -635,0 кДж/моль; Sº(CaO) = 39,7 Дж/моль·К; ∆Н°утв.(СО2)= -393,8 кДж/моль; Sº(CO2) = 213,8 Дж/моль·К.
В-10. Питома теплота плавлення заліза рівна 269,2 Дж/г. Температура плавлення його рівна 1539° С. Визначити зміну ентропії при плавленні 2 молів заліза.
В-11. Визначити ступінь розкладу МgСО3, якщо при термічному розкладі наважки масою 8,4 г затрачено 8,8 кДж тепла.
∆Н°утв.(MgO) = -601,2 кДж/моль;
∆Н°утв.(MgCO3) = -1096 кДж/моль;
∆Н°утв.(CO2) = -393,5 кДж/моль.
В-12. Яка реакція термодинамічно можлива за стандартних умов:
а) 2 КС1(к) + Вr2(г) = 2 КВr(к) + Сl2(г),
б) 2 КВr(к) + С12(г) = 2 КС1(к) + Вг2(г).
∆G0298 (КС1) = - 408,0 кДж/моль,
∆G0298 (КВг) = - 379,2 кДж/моль.
В-13. Визначте ∆G°298 реакції і покажіть, в якому напрямку можливий їхній перебіг за стандартних умов:
СuО(к) + С(гр) = Сu(к) + СO(г)
якщо ∆G0298 (CuO) = - 129,9кДж/моль,
∆G0298 (CO) = -137,2 кДж/моль.
В-14. При взаємодії 13,49 г А1 з надлишком сірки виділилось 127,2 кДж тепла. Визначте, скільки тепла виділиться при взаємодії трьох моль алюмінію з надлишком сірки.
В-15. Яку масу етену треба спалити, щоб нагріти 200 г води від 20 °С до 80 °С? (мольна теплоємність води
75,3 Дж/моль·К)
19 ЕЛЕКТРОХІМІЧНИЙ ЗАХИСТ МЕТАЛІВ
ВІД КОРОЗІЇ
(лабораторна робота)
Програмні питання
1. Поняття про електродний потенціал. Подвійний електричний шар.
2. Рівняння Нернста.
3. Стандартний водневий електрод. Ряд стандартних електродних потенціалів.
4. Гальванічний елемент. Напруга гальванічного елемента.
5. Корозія металів. Механізм електрохімічної корозії.
6. Захист металів від корозії: металічні і неметалічні покриття, електрохімічний захист, зміна властивостей корозійного середовища, легування металів.
Література
[1], [5], [20], [22]






