Лабораторна робота № 1
Тема: «ВИВЧЕННЯ ВЛАСТИВОСТЕЙ ГАЛОГЕНІВ
ТА ЇХ СПОЛУК»
Мета роботи: здобути в лабораторних умовах хлор, бром, йод; вивчити їх деякі властивості, якісні реакції.
Обладнання та реактиви: спиртівки, держаки, газовідвідні трубки, шпатель, штативи з пробірками, сірники, крохмаль, ”хлорна вода”, C6H6, H2S(розчин), Br2, I2, KI, MnO2, KMnO4,H2SO4(к.), HCl. NH4Clсух., AgNO3, KBr, KCl, колба, газовідвідна трубка, H2SO4конц., скляна пластина, циліндр, лійка крапельна, кристалізатор, синій лакмус.
Дослід 1 Одержання хлору та хлорної води
Виконання досліду
Зібрати прилад для отримання газів по схемі:
| На сухий KMnO4 (1) подіяти HCl (2) і через газовідвідну трубку (3) пропустити одержаний газ (Cl2) у склянку з водою до насичування (одержали хлорну воду). |
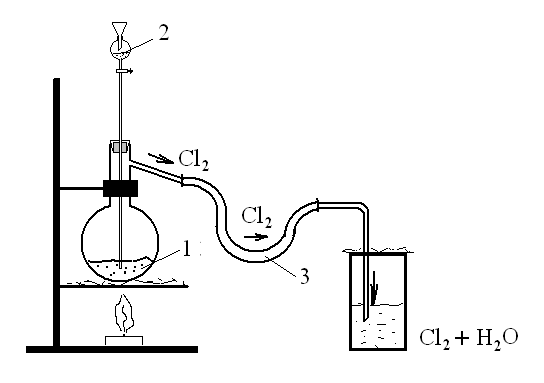
Фізичні властивості хлору: газ жовто-зеленого кольору, майже в 2,5 рази важчий за повітря. За кімнатної температури під тиском (приблизно 607,950Па) перетворюється на рідину. За звичайних умов в одному об’ємі Н2О розчиняється приблизно 2,5 об’ємів Cl2. Розчин хлору у воді називається хлорною водою (має зеленуватий колір і запах хлору).
Cl2 + H2O ↔ HCl + HClO
При взаємодії хлору з водою відбувається оборотна реакція, яка не проходить до кінця. Рівновага встановлюється тоді, коли прореагує 1/3 частина розчину хлору. Слабка кислота, що утворилася, розпадається по рівнянню:
2HClO ↔ 2HCl+O2, Kд (HClO) = 3,7∙10-8
По мірі розкладу НСlО рівновага зміщується у бік утворення продуктів реакції і в кінці процесу весь Cl2 прореагує з водою і в розчині залишається тільки НСl. Світло прискорює цю реакцію, тому хлорну воду рекомендується зберігати в темному місті.
HClO – сильний окисник.
Реакція гідролізу Cl2 є реакцією диспропорціювання:
Cl0 +1e → Cl-
ок-к процес відновлення,
Cl0 – 1e → Cl+
в -к процес окиснення,
тобто, один з атомів хлору відновлюється, а другий – окиснюється.
Дослід 2 Дослідження властивостей хлорної води
Виконання досліду
1 Виконати реакції, які показують наявність у хлорній воді Cl- та ClO-
а) показати наявність у хлорній воді Cl- можна за допомогою реакції з AgNO3 (якісна реакція на Cl-):
Cl- + Ag- → AgCl ↓
б) показати наявність у хлорній воді ClO- можна за допомогою реакції взаємодії з розчинами фуксину (або чорнил).
Спостерігаємо знебарвлення розчинів. (ClO- – сильний окисник).
2 До розчину синього лакмусу прилити рівний об’єм хлорної води. Спостерігаємо перехід синього кольору в червоний, а потім – повне знебарвлення.
Висновок: HClO – сильний окисник. Її утворенням пояснюється здібність знебарвлювати барвники та вбивати мікроорганізми. Сухий хлор не діє на барвники, але в присутності вологи відбувається знебарвлення забарвлених речовин атомарним киснем, який утворюється при розкладі HClO.
Дослід 3 Властивості брому
Виконання досліду
а) Нагріваємо у пробірці бромну воду та спостерігаємо її знебарвлення.
б) Вилучення брому розчинниками (бензол, хлороформ) з бромної води.
У пробірку налити бромну воду та додати бензол. Суміш енергійно перемішати. Бензольне кільце забарвлюється у жовтий колір. Ця реакція є якісною реакцією на Br2.
Фізичні властивості брому: бром – червоно-бура рідина, легко випаровується, утворюючи червоно-буру пару. Потрапляючи на шкіру людини, бром викликає тяжкі опіки. Він малорозчинний у воді, краще розчиняється в органічних речовинах: спирті, ефірі, бензолі, хлороформі.
в) Окиснювальні властивості брому.
До розчину H2S по краплям додавати бромну воду, перемішати:
H2S + Br2 = 2HBr + S↓
Br2° + 2е → 2Br-
↑о-к процес відновлення
S2- – 2е → S°
↑ в-к процес окиснення
Спостерігаємо знебарвлення розчину та утворення осаду сірки.
Br2 при взаємодії з сильним відновником (H2S) виявляє окисні властивості.
Дослід 4 Одержання йоду
Виконання досліду
У пробірку внести декілька кристалів йоду, MnO2 і перемішати. До суміші додати концентровану H2SO4 і нагріти:
KI+MnO2 + H2SO4 = MnSO4 +I2 +K2SO4 + H2O
__________
Спостерігаємо утворення фіолетових парів йоду.
Дослід 5 Властивості йоду
Виконання досліду
1 Сублімація йоду
В суху і чисту пробірку внести декілька кристалів йоду, підігріти.
Спостерігаємо: пробірка заповнюється фіолетовими парами I2.
Це явище - сублімація - перехід йоду з твердого стану в газоподібний, не перетворюючись на рідину.
2 Розчинність йоду
У пробірку з водою внести кристали йоду, перемішати. Помітного розчинення при цьому не спостерігаємо. Додати в цю ж пробірку декілька кристалів KI та через хвилину розчин перемішати. Спостерігаємо помітне розчинення йоду у розчині KI. Прилити до цього розчину бензол, перемішати. Спостерігаємо: бензольне кільце набуває малинового кольору. (Реакція може бути якісною на вільний йод.)
3 Аналітична реакція на йод
До розчину йоду прилити крохмаль. Спостерігаємо синє забарвлення розчину, утворюється комплексно - адсорбційна сполука йоду з крохмалем. Ця реакція є якісною на вільний йод (I2).
До розчину KI додати крохмаль. Змін не спостерігаємо, тобто KI містить йон I-.
Фізичні властивості йоду: йод - тверда кристалічна речовина темно-сірого кольору із слабким металічним блиском.
Дослід 6 Порівняння активності галогенів
Виконання досліду
У пробірку з розчинами KCl та KBr прилити хлорну воду, а потім додати бензол і перемішати:
KI + Cl2 = _______________________________________________
KBr + Cl2 = ______________________________________________
Висновок: В ряду F-Cl-Br-I хімічна активність послідовно зменшується. Так, фтор витісняє із сполук хлор, бром; хлор – бром і йод; бром – тільки йод:
Br2 + KI = I2 + 2KBr.
Усі галогени мають різкий запах, викликають подразнення дихальних шляхів, токсичні речовини.
Дослід 7 Синтез HСl↑
Виконання досліду
| У колбу Вюрца насипати сухого NH4Cl і через краплинну лійку прилити H2SO4конц. в такій кількості, щоб вона покрила собою сіль. Бокову трубку колби з’єднати з промивною склянкою, в якій знаходяться H2SO4конц. |
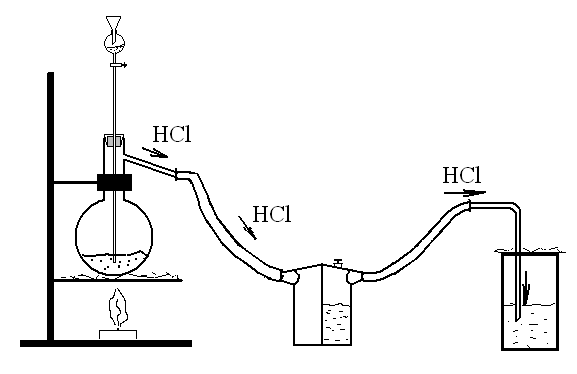
Зігнену під прямим кутом скляну трубку, яка з’єднана з промивною склянкою, опустити до дна циліндра для збирання газу. Коли реакція закінчиться (при нормальних умовах), її необхідно продовжити при нагріванні. Інтенсивність процесу залежить від температури.
Рівняння реакції:
NH4Cl + H2SO4 → ________________________ (на холоду).
NH4Cl → ______________________________(при t°).






