Прежде отметим достоинство этого уравнения. Уравнение Ван-дер-Ваальса правильно описывает явления, связанные с изменением плотности газов при изменении температуры и давления, взаимные переходы жидкости и газа. Из уравнения Ван-дер-Ваальса вытекает наличие у веществ критической точки. В то же время теория Ван-дер-Ваальса имеет существенные недостатки:
а) Параметры  и
и  , входящие в уравнение Ван-дер-Ваальса не являются постоянными. Они зависят от температуры, хотя по смыслу уравнение Ван-дер-Ваальса
, входящие в уравнение Ван-дер-Ваальса не являются постоянными. Они зависят от температуры, хотя по смыслу уравнение Ван-дер-Ваальса  и
и  должны быть постоянными, характерными для данного вещества величинами;
должны быть постоянными, характерными для данного вещества величинами;
б) Другое количественное расхождение между теоретическим уравнением и опытом связано со значениями критических параметров Рк, Vк, Тк. Из системы уравнений (5.8) следует, что между этими величинами должно существовать соотношение:
 ,
,
не зависящее от природы вещества. Опыт же показывает, что хотя величина  постоянна для многих веществ, но равна 3,7. Вместо вытекающего из уравнения Ван-дер-Ваальса соотношения
постоянна для многих веществ, но равна 3,7. Вместо вытекающего из уравнения Ван-дер-Ваальса соотношения  , опыт показывает, что значительно лучше выполняется равенство
, опыт показывает, что значительно лучше выполняется равенство  . Из приведенных выше параметров следует, что уравнение Ван-дер-Ваальса только качественно правильно описывает явления, происходящие в реальных газах. Для количественных оценок оно является грубым.
. Из приведенных выше параметров следует, что уравнение Ван-дер-Ваальса только качественно правильно описывает явления, происходящие в реальных газах. Для количественных оценок оно является грубым.
В настоящее время принято описывать состояние реального газа более общим уравнением в виде ряда:

Коэффициенты В, С …, которые определяются или из опыта или теоретически, называются вириальными коэффициентами, причем все они зависят от температуры.
Внутренняя энергия газа Ван-дер-Ваальса
Как мы отметили выше, внутренняя энергия неидеальных газов U зависит не только от температуры Т, но и от объема V, т.е.
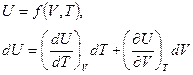 .
.
Отметим, что  . Получим выражение для
. Получим выражение для 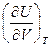 . С этой целью запишем I закон термодинамики в виде:
. С этой целью запишем I закон термодинамики в виде:
 .
.
Тогда
 .
.
Согласно правилам Максвелла, из выражения (1.49), имеем:
 .
.
Таким образом,
 . (5.9)
. (5.9)
В результате выражение для внутренней энергии газа можно записать в виде:
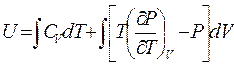 . (5.10)
. (5.10)
Применим формулу (5.10) для вычисления внутренней энергии газа, описываемого уравнением Ван-дер-Ваальса:
 .
.
В этом случае легко заметить
 .
.
Отсюда
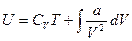 .
.
Проинтегрировав вторые слагаемые, получим:
 ,
,
где В - постоянная интегрирования. Для определения значения В, воспользуемся условием, что при  , газ становится бесконечно разреженным, т.е. он должен обладать свойствами идеального газа, для которого
, газ становится бесконечно разреженным, т.е. он должен обладать свойствами идеального газа, для которого 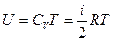 . Это значит, что
. Это значит, что  . Таким образом, внутренняя энергия газа Ван-дер-Ваальса определяется выражением:
. Таким образом, внутренняя энергия газа Ван-дер-Ваальса определяется выражением:
 . (5.11)
. (5.11)






