Благодаря присутствию растворенного вещества число молекул растворителя на его поверхности (также в объеме) меньше, чем их было в чистом растворителе. В связи с этим число испаряющихся с такой поверхности молекул растворителя, а значит и давление его насыщенных паров над раствором, будет меньше, чем над поверхностью чистого вещества. Легко понять, что эта упругость пара должна быть пропорциональна концентрации растворителя в растворе. Если в растворителе А растворено вещество В, причем концентрация А равно  , то давление пара
, то давление пара 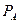 определяется равенством:
определяется равенством:
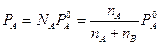 , (7.1)
, (7.1)
где  и
и  - числа молей вещества А и В соответственно,
- числа молей вещества А и В соответственно, 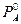 - давление насыщенных паров чистого вещества А при той же температуре. Те же рассуждения относятся и к растворенному веществу, для которого справедливо аналогичное равенство:
- давление насыщенных паров чистого вещества А при той же температуре. Те же рассуждения относятся и к растворенному веществу, для которого справедливо аналогичное равенство:
 , (7.2)
, (7.2)
где 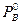 - давление насыщенных паров над чистым веществом В. Формулы (7.1) и (7.2) выражают так называемый закон Рауля. Этот закон справедлив для идеальных растворов и для любых слабых растворов. Уравнения (7.1) и (7.2) могут быть переписаны в виде:
- давление насыщенных паров над чистым веществом В. Формулы (7.1) и (7.2) выражают так называемый закон Рауля. Этот закон справедлив для идеальных растворов и для любых слабых растворов. Уравнения (7.1) и (7.2) могут быть переписаны в виде:
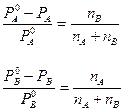 . (7.3)
. (7.3)
В любой части этих равенств стоит относительное изменение давления пара одной из компонент в результате того, что она входит в состав раствора. Из формулы видно, что относительное изменение равновесного давления пара одной из компонент равно концентрации другой компоненты. В частности, когда растворенное вещество нелетуче, формула (7.3) означает, что относительное изменение упругости насыщенного пара растворителя равно концентрации растворенного вещества.
Закон Генри
Закон Рауля в идеальных растворах в равной мере относится к растворителю и к растворенному веществу. Согласно этому закону упругость насыщенного пара растворенного вещества 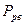 над раствором пропорциональна концентрации этого вещества в растворе:
над раствором пропорциональна концентрации этого вещества в растворе:
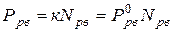 . (7.4)
. (7.4)
Здесь речь идет о насыщенном паре. Это значит, что число частиц, переходящих из раствора в пар, равно числу частиц, возвращающихся из пара обратно в раствор. Поэтому с равным правом можно говорить об испарении растворенного вещества из раствора и о растворении его пара в растворителе. Если рассмотреть именно последний процесс, т.е. процесс растворения пара (или вообще любого газа) в жидкости, то равенство (7.4) следует переписать в виде:
 .
.
Это означает, что концентрация газа, растворенного в жидкости, пропорциональна его давлению над раствором. Это положение называется законом Генри. Этот закон строго справедлив только для идеальных растворов.
Осмотическое давление
 Если в одном и том же сосуде находятся, соприкасаясь друг с другом, раствор и чистый растворитель, то частицы растворенного вещества будут переходить в растворитель и этот процесс диффузии закончится только тогда, когда будет достигнуто равновесие. Подобно тому, как газ оказывает давление на стенки сосуда, растворенное вещество тоже должно оказывать давление на ту границу, которая разделяет раствор и чистый растворитель или два раствора с различными концентрациями (разность концентраций здесь играет такую же роль, какую в газах играют разность давлений). Это можно наблюдать, если поместить между раствором и чистым растворителем полупроницаемую перегородку, т.е. перегородку, через которую легко проходит растворитель, но не проходит растворенное вещество (рис.1). Когда растворитель будет переходить в раствор уровень жидкости в той части сосуда, где находится раствор, будет повышаться. Частицы растворенного вещества как бы стремятся продвинуть перегородку сквозь растворитель, но фактически смещается не жестко закрепленная перегородка, а уровень жидкости (если бы можно было сделать полупроницаемый подвижный поршень, то смещался бы именно он). Давление, которое оказывает растворенное вещество на полупроницаемую перегородку, называется осмотическим давлением, а вызванное этим проникновение растворителя в раствор называется осмосом. Подъем уровня жидкости будет продолжаться до тех пор, пока возникшее гидростатическое давление не окажется равным осмотическому давлению.
Если в одном и том же сосуде находятся, соприкасаясь друг с другом, раствор и чистый растворитель, то частицы растворенного вещества будут переходить в растворитель и этот процесс диффузии закончится только тогда, когда будет достигнуто равновесие. Подобно тому, как газ оказывает давление на стенки сосуда, растворенное вещество тоже должно оказывать давление на ту границу, которая разделяет раствор и чистый растворитель или два раствора с различными концентрациями (разность концентраций здесь играет такую же роль, какую в газах играют разность давлений). Это можно наблюдать, если поместить между раствором и чистым растворителем полупроницаемую перегородку, т.е. перегородку, через которую легко проходит растворитель, но не проходит растворенное вещество (рис.1). Когда растворитель будет переходить в раствор уровень жидкости в той части сосуда, где находится раствор, будет повышаться. Частицы растворенного вещества как бы стремятся продвинуть перегородку сквозь растворитель, но фактически смещается не жестко закрепленная перегородка, а уровень жидкости (если бы можно было сделать полупроницаемый подвижный поршень, то смещался бы именно он). Давление, которое оказывает растворенное вещество на полупроницаемую перегородку, называется осмотическим давлением, а вызванное этим проникновение растворителя в раствор называется осмосом. Подъем уровня жидкости будет продолжаться до тех пор, пока возникшее гидростатическое давление не окажется равным осмотическому давлению.
Осмотическое давление, как показывает опыт, пропорционально концентрации раствора и обратно пропорционально его объему. Оно зависит также от температуры. Вант-Гофф показал, что связь между этими величинами имеет вид:
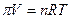 ,
,
где 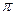 - осмотическое давление,
- осмотическое давление,  - объем раствора,
- объем раствора,  - число молей растворенного вещества. Это выражение называется законом Вант-Гоффа. Полное сходство уравнения закона Вант-Гоффа с уравнением состояния идеальных газов показывает, что частицы растворенного вещества в слабом растворе ведут себя так же, как и молекулы идеального газа.
- число молей растворенного вещества. Это выражение называется законом Вант-Гоффа. Полное сходство уравнения закона Вант-Гоффа с уравнением состояния идеальных газов показывает, что частицы растворенного вещества в слабом растворе ведут себя так же, как и молекулы идеального газа.
Осмотическое давление не зависит от вида полупроницаемой перегородки или от рода растворителя. Сходство в поведении растворенного вещества и идеального газа обусловлено тем, что в сильно разбавленном растворе, частицы растворенного вещества не взаимодействуют между собой, так же как не взаимодействуют частицы идеального газа.




