 Испарение жидкости происходит с ее поверхности. Поэтому изменение свойств поверхностного слоя должно изменить условия равновесия между жидкостью и паром над ней. В частности, на условиях равновесия, а значит и на упругости насыщенного пара должна сказаться кривизна поверхности жидкости. Это значит, упругость насыщенного пара над кривой поверхностью должна отличаться от упругости его над плоской поверхностью. Вычислим, насколько упругость насыщенного пара над кривой и плоской поверхностями отличаются друг от друга.
Испарение жидкости происходит с ее поверхности. Поэтому изменение свойств поверхностного слоя должно изменить условия равновесия между жидкостью и паром над ней. В частности, на условиях равновесия, а значит и на упругости насыщенного пара должна сказаться кривизна поверхности жидкости. Это значит, упругость насыщенного пара над кривой поверхностью должна отличаться от упругости его над плоской поверхностью. Вычислим, насколько упругость насыщенного пара над кривой и плоской поверхностями отличаются друг от друга.
Представим себе замкнутый сосуд с жидкостью, в которую частично погружена капиллярная трубка К, полностью смачиваемая жидкостью (рис.11).
Под действием капиллярных сил жидкость в трубке поднимается на высоту 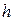 , определяемую формулой
, определяемую формулой
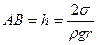 . (6.18)
. (6.18)
Упругость пара в точке. В, т.е. над вогнутой поверхностью можно определить, пользуясь барометрической формулой
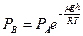 . (6.19)
. (6.19)
Поставив в (6.19) значение  из (6.18), получим:
из (6.18), получим:
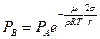 (6.20)
(6.20)
или
 . (6.21)
. (6.21)
Разложив в (6.20) экспоненту в ряд Тейлора и, ограничиваясь первыми двумя членами разложения, имеем:
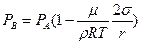 . (6.22)
. (6.22)
Если учесть, что насыщенный пар подчиняется уравнению состояния идеального газа
 ,
,
где 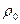 - плотность насыщенного пара, уравнение (6.22) можно переписать в виде:
- плотность насыщенного пара, уравнение (6.22) можно переписать в виде:
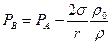 . (6.23)
. (6.23)
Таким образом, упругость насыщенного пара над вогнутой поверхностью меньше, чем над плоской на величину  . Очевидно, что точно таким же образом можно показать, что над выпуклой поверхностью упругость насыщенного пара больше, чем под плоской на ту же величину
. Очевидно, что точно таким же образом можно показать, что над выпуклой поверхностью упругость насыщенного пара больше, чем под плоской на ту же величину 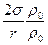 .
.
Вопросы для самоконтроля знаний студентов
1. Запишите выражение для коэффициента сжимаемости.
2. Чем объясняется малая сжимаемость жидкостей?
3. Как зависит коэффициент сжимаемости жидкостей от давления и температуры?
4. Запишите выражение для коэффициента объемного расширения жидкостей.
5. Каковы особенности теплоемкости жидкостей?
6. Чем объясняется низкое значение коэффициента диффузии в жидкостях?
7. Каков физический смысл коэффициента поверхностного натяжения?
8. Что такое сила поверхностного натяжения?
9. Наблюдаются случаи удержания на поверхности жидкости тела, плотность которого больше, чем плотность жидкости. Чем это объясняется?
10. Как объясняется явление, когда тело с плотностью, меньшей плотности жидкости, погружается в жидкость?
11. Что такое капиллярное давление?
12. Что такое краевые углы?
13. Запишите условие равновесия жидкости на границе двух сред.
14. Запишите условие равновесия жидкости на границе с твердым телом.
15. Как определяется сила сцепления между смачиваемыми пластинами?
16. Молекулы жидкости, подобно частицам твердого тела, совершают колебания около некоторых положений равновесия. В чем же отличие в поведении молекул жидких тел от поведения молекул в газах и в твердых телах?
17. В чем причина малой сжимаемости жидкостей и особых свойств поверхностного слоя?
18. В опыте Плато капля оливкового масла помещается в смесь спирта с водой такой плотности, что капля масла находится во взвешенном состоянии. Какова форма капли масла и почему?
19. Каким должен быть наибольший диаметр стальной иголки, чтобы смазанная жиром, она могла держаться в горизонтальном положении на поверхности воды?
20. Как изменяются размеры больших и малых капель, находящихся рядом при испарении.
21. Что можно говорить о соотношении между теплоемкостями Ср и Cv для жидкостей?
22. Какие факторы делают структуру жидкостей промежуточной между твердыми телами и жидкостями?
23. 3а счет каких физических факторов сжимаемость реального газа при малом давлении больше, чем идеального, а при большом — меньше?
24. С какими факторами на молекулярном уровне связана скрытая теплота перехода?
25. Какие соображения позволяют выбрать давление, при котором должна быть проведена горизонтальная изотерма реального газа, соответствующая двухфазному состоянию?
26. Как наглядно объяснить зависимость знака дифференциального эффекта Джоуля-Томсона от давления газа?
27. Каким физическим условиям в газе соответствует точка инверсии дифференциального эффекта Джоуля-Томсона?
28. Поверхностное натяжение не зависит от геометрических размеров сосудов или объема жидкости. Почему же его существование наиболее четко проявляется лишь в узких трубках и маленьких каплях?
29. Чем свойства пара отличаются от свойств газа? При каких условиях к пару можно применить газовые законы?
30. Изменяется ли температура поверхностной пленки жидкости при ее растяжении?
31. Как зависит поверхностное натяжение жидкости от температуры?
32. При каких условиях жидкость смачивает твердое тело?
33. Как связано избыточное давление поверхностной пленки жидкости с кривизной ее поверхности?
34. Как рассчитать высоту капиллярного подъема жидкости?
Глава 7. Жидкие растворы
Свойства растворов
Растворами называют физически однородные (гомогенные) смеси двух или нескольких веществ. Физическая однородность достигается равномерным перемешиванием молекул. Если одного вещества в растворе больше, чем других, то оно называется растворителем, а другие вещества - растворенными. Растворы называются слабыми или разбавленными, если число молекул растворенных веществ очень мало по сравнению с числом молекул растворителя. Растворы же, содержащие много растворимых веществ называются крепкими.
Рассмотрим свойства бинарных растворов, состоящих только из двух веществ - растворителя и растворенного вещества. Количественно растворы характеризуются концентрацией, определяющей содержание той или иной части раствора. Существует много способов выражения концентрации:
1. Весовая доля - отношение веса данной составной части к весу всего раствора. Если выразить ее в процентах, то мы получим весовую концентрацию.
2. Мольная доля - отношение числа молей растворенного вещества к общему числу молей в растворе. Выраженная в процентах, она называется молярной концентрацией. Если раствор содержит 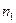 молей одного вещества и
молей одного вещества и 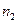 молей второго, то молярные концентрации выражаются следующим образом:
молей второго, то молярные концентрации выражаются следующим образом:
молярная концентрация вещества 1
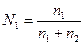 ,
,
молярная концентрация вещества 2
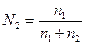 .
.
3. Молальность - число молей растворенного вещества в 1000 граммах растворителя. При изучении свойств растворов, концентрация наряду с давлением и температурой, является основным параметром состояния.
В некоторых случаях вещества могут растворяться друг в друге неограниченным образом, т.е. концентрация раствора может быть любое. Примером может быть раствор спирта в воде. Существуют, однако, и такие вещества, которые в данном растворителе способны растворяться только до определенной наивысшей концентрации. Дальнейшее же растворение при данных температуре и давлении невозможно. Эта максимальная равновесная концентрация называется растворимостью. Раствор с максимальной концентрацией называется насыщенным раствором. Растворимость обычно зависит от температуры и давления и возрастает с повышением температуры и уменьшается с повышением давления.
Многие свойства растворов даже при малых концентрациях растворенного вещества заметно отличаются от свойств чистых жидкостей, в частности, от свойств чистого растворителя. Это связано с тем, что в растворах мы имеем дело с более сложными взаимодействиями частиц. Свойства растворов также как и свойства чистых веществ определяются взаимодействием частиц между собой. Но в чистых жидкостях все частицы одинаковы, а в растворе имеется частицы разных веществ. Если, например, в жидкости А растворено вещество В, то в таком растворе играют роль взаимодействие частиц А между собой (взаимодействия А-А), частиц В между собой (В-В), частиц А с частицами В (А-В). Все эти взаимодействия различны, величина и относительная роль каждого из них зависит от концентрации. В связи с этим жидкий раствор является значительно более сложной системой, чем обычная жидкость.
Само растворение является следствием взаимодействия частиц растворенного вещества с частицами растворителя. Именно эти взаимодействия ослабляют силы притяжения, которые удерживают вместе частицы растворяемого вещества, так что благодаря тепловым движениям они расходятся и постепенно распределяются по всему объему растворителя.
Разделение частиц растворенного вещества и перевод их в раствор требует затраты энергии, поскольку частицы до растворения связаны друг с другом силами притяжения. Против этих сил должна быть совершена работа. Работа эта совершается силами взаимодействия между частицами растворенного вещества и растворителя. Энергию растворения принято называть теплотой растворения.
Так как расходуемая на растворение (разделение частиц растворенного вещества) теплота заимствует из запасов внутренней энергии растворителя, то растворение должно приводить к охлаждению растворителя и значит всего раствора. Так и происходит во многих случаях, например, при растворении солей в воде. Однако растворение часто сопровождается и нагреванием раствора. Например, сильное нагревание жидкости, сопровождающее растворение серной кислоты в воде. Объясняется это тем, что между частицами растворителя и растворенного вещества могут действовать особенно большие силы притяжения, благодаря которым они с большими скоростями устремляются друг к другу и соединяются в особые комплексы. Выделяющееся за этот счет тепло не только компенсирует, но и значительно превосходит эффект охлаждения при растворении. Возможны и такие растворы, при образовании которых теплота не выделяется и не поглощается. Для этого необходимо, чтобы силы взаимодействия любых частиц в растворе были одинаковы. Такие растворы называют идеальными растворами. К ним близки некоторые реальные растворы, например, метиловый спирт в этиловом спирте, бензол в толуоле. По некоторым признакам могут считаться идеальными и любые реальные растворы, если концентрация растворенного вещества в них достаточно мала.






