Химические свойства альдегидов и кетонов определяются наличием карбонильной группы. Двойная связь С=О в карбонильной группе имеет некоторое сходство с двойной связью в этиленовых углеводородах (сочетание s- и p-связей), но отличается сильной поляризацией вследствие различной электроотрицательности образующей ее атомов (С и О). Дипольный момент карбонильной группы – около 2,7 D, поэтому углеродный атом карбонильной группы обладает электрофильными свойствами и атакуется нуклеофильными реагентами, в то время как двойная связь в алкенах атакуется электрофильными реагентами. Радикалы, способные увеличить положительный заряд на углеродном атоме, повышают реакционную способность карбонильных соединений.
Поляризация связи С=О является основной причиной высокой реакционной способности карбонильных соединений. При этом отрицательно поляризованная часть молекулы атакующего связь С=О реагента присоединяется к электрофильному центру (атому С), в то время как ее положительная часть к кислородному атому. Альдегиды химически активнее, чем кетоны, что связано с меньшей компенсацией положительного заряда на атоме углерода за счет индукционного эффекта одного алкильного радикала против двух у кетонов. Наиболее реакционоспособен по этой причине формальдегид.
Характерными реакциями для альдегидов и кетонов являются прежде всего реакции нуклеофильного присоединения по связи С=О. Эти процессы протекают ступенчато по следующей схеме:
А: В ® А+ +:В-
Медленно
Сd+= Оd- +:В- ¾¾® -- С –О -
½
В
Быстро
--С–О - + А+ ¾¾¾® --СОА
½ ½
В В
По такому механизму к альдегидам присоединяются такие реагенты, как синильная кислота, гидросульфит натрия, спирты, вода (нестойкие гидраты для большинства альдегидов и кетонов), реактив Гриньяра (магнийгалогеналкилы), водород.
1. Присоединение синильной кислоты с образованием a-оксинитрилов, омылением которых получают a-оксикислоты:
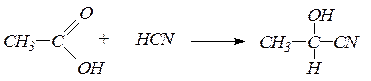
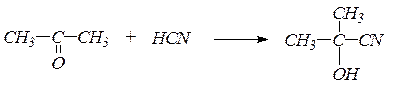
2. Присоединение гидросульфита натрия дает кристаллические вещества, называемые бисульфитными производными альдегидов и кетонов:
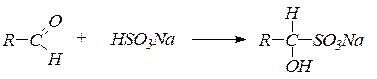
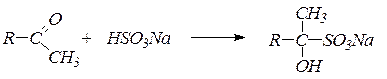
Реакция с бисульфитом натрия используется для качественного определения альдегидов и кетонов, а также для их выделения и очистки. В реакцию с бисульфитом натрия вступают только метилкетоны.
3. Присоединение воды. В водных растворах карбонильные соединения существуют в равновесии с диолами – продуктами присоединения воды по связи С=О:
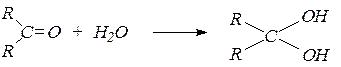
Гидраты незамещенных альдегидов и кетонов нестабильны, за исключением гидрата формальдегида СН2(ОН)2.
4. Присоединение спиртов:
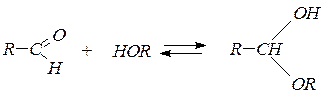
полуацеталь
В присутствии следов минеральных кислот образуются ацетали:
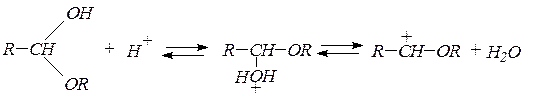
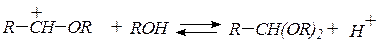
ацеталь
5. Присоединение магнийгалогеналкилов, гидролиз которых приводит к получению первичных, вторичных и третичных спиртов соответственно:
НСОН + RMgBr ® R-CH2–OMgBr
R–CH2-OMgBr + H2O ® R–CH2-OH + Mg(OH)Br
R COH + RMgBr ® R2–CH–OMgBr
R2-CH-OMgBr + H2O ® R2-CH-OH + Mg(OH)Br
R2C=O + RMgBr ® R3COMgBr
R3COMgBr + H2O ® R3C-OH + Mg(OH)Br
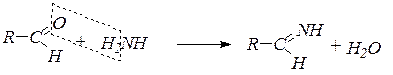
Некоторые реакции присоединения протекают с отщеплением молекул воды. К таковым относятся реакции взаимодействия альдегидов с аммиаком с образованием альдиминов (кетоны подобных соединений не образуют), с гидроксиламином с образованием альдоксимов и кетоксимов, с гидразином с образованием гидразонов.
6. Взаимодействие с аммиаком:
Альдимины легко полимеризуются в циклические альдегидаммиаки, используемые как ускорители вулканизации каучуков:
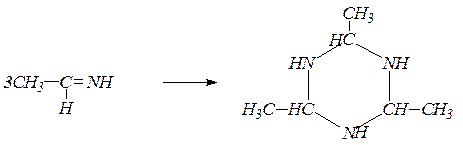
Взаимодействием формальдегида с аммиаком получают уротропин:
6 НСОН + 4NH3 ® (CH2)6N4 + 6H2O
7. Образование оксимов с гидроксиламином:
R – CH = O + H2N-OH ¾® H2O + R-CH = NOH
альдоксим
R2C = O + H2N-OH ¾® R2C = N – OH + Н2О
кетоксим
Эти реакции применяют для количественного определения карбонильных соединений, используя солянокислый гидроксиламин.
8. Взаимодействие с гидразином и его замещенными. В зависимости от условий гидразин образует гидразоны:
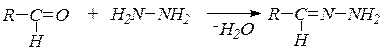
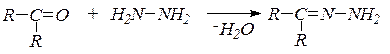
или азины (альдазины и кетазины):
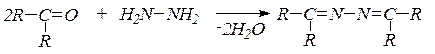
9. Реакции полимеризации альдегидов в присутствии следов минеральных кислот. При этом формальдегид может превращаться в параформ:
nСН2О ¾® (-CН2О-)n
со степенью полимеризации n =8-10, полиформальдегид со степенью полимеризации n=1000, циклический продукт – триоксиметилен:
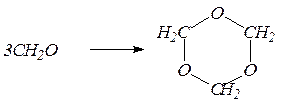
Полимеризация уксусного альдегида приводит к образованию паральдегида:
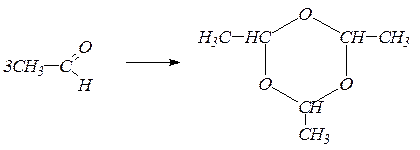
паральдегид
10. Реакции конденсации альдегидов, приводящие к образованию альдолей, называют альдольной конденсацией (а). Конденсация, сопровождающаяся отщеплением воды и образованием непредельного альдегида, называется кротоновой конденсацией (б). Альдольная конденсация кетонов протекает в более жестких условиях с образованием b-кетоноспиртов (в):
а) СН3СНО + НСН2СОН ® СН3СН(ОН)СН2СНО
3-оксибутаналь (альдоль)
|
кротоновый альдегид
|
диацетоновый спирт окись мезитила
(4-окси-4-метилпентанон-2) (4-метилпентен-3-он-2)
Из соединений, участвующих в ключевой стадии при альдольной конденсации, одно должно быть донором пары электронов, а другое – акцептором.
Альдегиды, не способные к альдольной конденсации, вступают в реакцию Канниццаро (реакция дисмутации альдегидов):
2 (СН3)2СНСНО + КОН ® (СН3)2СНСООК + (СН3)2СНСН2ОН
11. Сложноэфирная конденсация (по Тищенко) в присутствии алкоголятов алюминия приводит к получению из ацетальдегида этилацетата:
СН3СНО + СН3СНО ® СН3СООС2Н5
12. Получение пентаэритрита (щелочной катализ ):
СН3СНО + 3СН2О ® С (СН2ОН)4
13. Замещение карбонильного кислорода хлором при действии РCI5 позволяет получить геминальные дигалогенпроизводные:
R2C=О + РСI5 ® R2CCI2 + POCI3
14. Карбонильная группа оказывает активирующее действие на реакционную способность связанных с ней углеродных атомов (особенно a-атомов), вследствие чего для альдегидов и кетоновхарактерны реакции замещения в углеводородном радикале:
СН3СН2СНО + CI2 ® CH3CHCICHO
Реакции отличаются от реакций галогенирования алканов тем, что протекают в присутствии кислых или щелочных катализаторов.
При пропускании хлора через ацетальдегид получается 2,2,2-трихлорацетальдегид (хлораль) –CI3-CH=O, который широко используется в органическом синтезе.
15. Галоформная реакция, индуцируемая основаниями, приводит к получению галоидпроизводных типа СНHaI3 и может служить качественной реакцией на метилкетоны.
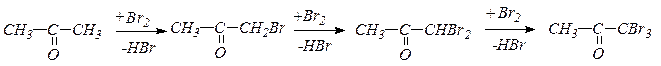
Образующийся тригалогенкетон легко атакуется основанием, что приводит к расщеплению С-С связи:
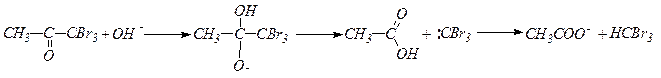
Образование иодоформа (осадок в виде желтых кристаллов) является качественной реакцией на группу СН3СО-.
16. Реакции окисления. Альдегиды окисляются до карбоновых кислот даже такими слабыми окислителями, как аммиачный раствор оксида серебра (реактив Толленса). Эта качественная реакция на альдегиды известна под названием “реакции серебряного зеркала”:
RCOH + 2[Ag(NH3)2]OH ® RCOONH4 + 2Ag + 3NH3 + H2O
Альдегиды окисляются также феллинговой жидкостью (“реакция медного зеркала”).
Кетоны окисляются труднее. Они более устойчивы к слабым окислителям и к кислороду воздуха. При действии сильных окислителей происходит разрыв углеродной цепи и образование смеси кислот. При окислении симметричных кетонов образуется не более двух кислот:
[О]
СН3-СН2-СО-СН2-СН3 ® СН3-СН2-СООН + СН3СООН
Непредельные альдегиды и кетоны содержат непредельные радикалы, связанные с карбонильной группой. Химические свойства таких соединений обусловлены наличием как двойной связи, так и карбонильной группы. Особый интерес представляют a-,b-ненасыщенные (сопряженные) альдегиды и кетоны, присоединение галогеноводородов у которых идет против правила Марковникова.
Простейшими представителями таких соединений являются акролеин, кротоновый альдегид, а из кетонов – метилвинилкетон.
Экспериментальная часть






