Фотохромизм - это обратимое, вызванное светом (УФ, видимый, ИК) изменение спектра поглощения соединения. Оно обусловлено переходом соединения из формы A в форму B и обратно [12].
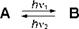
|
|
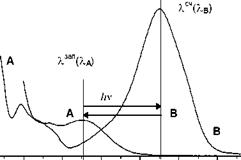
| Рис. 1. Спектр типичного фотохромного соединения: Спектр термически стабильной A и фотоиндуцированной B форм фотохромного соединения. В полосе формы A записывают, а в полосе формы B считывают и стирают информацию. |
| Х/нм |
| D |
На практике наиболее часто имеют дело с соединениями, у которых, по крайней мере, одна форма поглощает свет в видимой области спектра (рис. 1).
Если соединения A и B поглощают только в УФ-области спектра, то такую разновидность фотохромии называют фототропией.
B может представлять собой одно или несколько термодинамически метастабильных или нестабильных соединений. При переходе A в B изменяются электронная структура хромофора и соответственно спектр поглощения соединения, а также другие важные свойства вещества, включая оптические (коэффициент преломления), электрические (проводимость, фотопроводимость), термодинамические (энтальпия образования, температура плавления) и другие характеристики. По способности к обратимости различают несколько типов фотохромных систем. Система может быть фотообратимой, т. е. окрашенная форма В переходит при облучении светом в своей длинноволновой полосе поглощения обратно в бесцветную форму A в результате так называемого оптического отбеливания. Термообратимой называют фотохромную систему, которая спонтанно при комнатной температуре или при нагревании переходит в исходную форму A. Многие фотохромные реакции в большей или меньшей степени сопровождаются побочными или необратимыми реакциями, в результате чего фотохромное соединение разрушается (фотохромная система устает).
Рассмотрим механизмы, которые лежат в основе превращений наиболее известных фотохромных органических соединений.
1. Фотодиссоциация
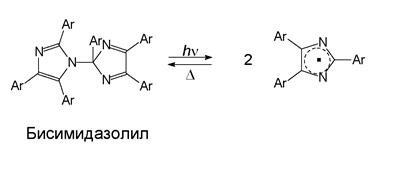
Примером процесса с гомолитическим разрывом связи может служить фотолиз гексафенилбисимидазолила и октафенилдипиррола, которые реагируют по схеме:
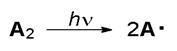
С относительно высокими квантовыми выходами возникают глубокоокрашенные радикалы А, которые могут термически рекомбинировать с образованием исходных веществ
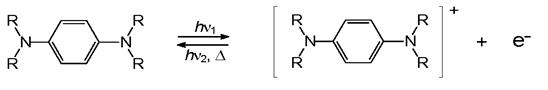
2. Фотоионизация
Обратимое изменение цвета может происходить также в результате фотоиндуцированных обратимых окислительно-восстановительных реакций (редокс- реакций). Окрашенной формой в зависимости от типа системы может быть A или B. Особый случай редокс-фотохромии - обратимая фотоионизация. Таким образом из п-фенилендиаминов возникают известные глубокоокрашенные красители типа Вюрстера голубого.
3. Фотоперегруппировки
а) Фототаутомерия
Фотохромизм ряда соединений связан с индуцированным светом перемещением атома водорода - фототаутомерией. Наиболее важные случаи фототаутомерии - кетоенольная, нитро-аци-нитро- и фототаутомерия некоторых комплексов металлов. В первых двух случаях внутримолекулярный сдвиг атома водорода происходит в шестичленном переходном состоянии. Термически стабильны орто-замещенные ароматические соединения, которые в результате облучения дают глубокоокрашенные таутомеры, имеющие хиноидную структуру.
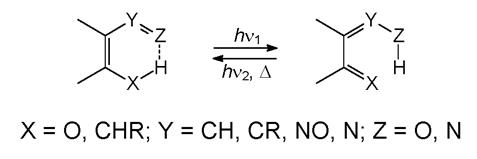
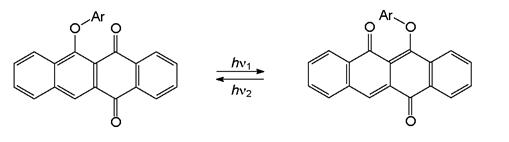
b) Фотозамещение
Интересный тип фотохромии (внутримолекулярное обратимое ароматическое фотозамещение) обнаружен у 6-арилокси-5,12-нафтаценхинона и некоторых других конденсированных ароматических соединений аналогичного типа.
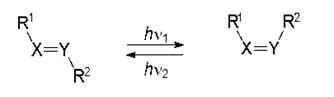
c) Фотоизомеризация. Фотохимические превращения транс-формы органического соединения в цис-форму (транс-цис-изомерия) широко распространены и детально изучены. Пространственная транс-цис-изомеризация обусловлена затрудненным вращением вокруг двойной связи и является причиной фотохромных изменений в целом ряде органических соединений. В силу малого отличия электронных структур исходных и конечных продуктов спектральные изменения в случае транс-цис-изомеризации в сравнении с другими фотохромными процессами, как правило, менее значительны. Эти формы различаются по энергии на величину ∆H от 3 до 25 кДж/моль.
|
транс-изомер цис-изомер
II. Общая часть.
Целью данной работы был синтез 2,2,-диметил-4-нитро-2Н-бензимидазол-1,3-диоксида и изучение его некоторых свойств.
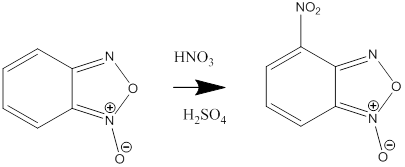
Температура плавления полученного в результате синтеза соединения 143-144ºC. Данная реакция описана так же в книге[14]. Присутствие нитрогруппы в соединении было подтверждено ИК и УФ спектрами. УФ-спектр, λ max/нм (lg ε): 270 (3.31), 405 (3.73). ИК-спектр (КBr), ν/ см-1: 1527, 1357(NO2), Температура плавления полученного соединения, соответствует литературным данным.
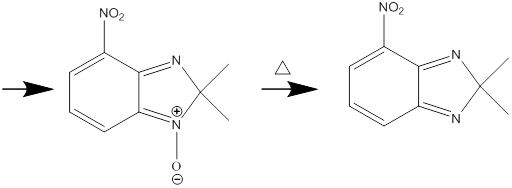
Следующей стадией было взаимодействие полученного соединения с изопропанолом в серной кислоте, которое приводит к образованию 2,2,-диметил-4-нитро-2Н-бензимидазол-1,3-диоксида
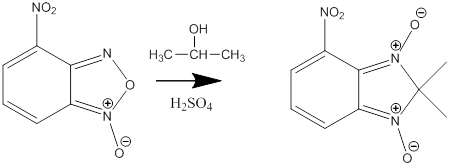
Механизм данной реакции был показан ранее в литературном обзоре.
В ИК спектре соединения наблюдаются полосы поглощения при 1537 см -1, 1357 относящие к колебаниям нитрогруппы. В спектре ПМР наблюдаются сигналы протонов в виде синглета двух метильных групп в области 1,68 м.д.,также наблюдается сигналы протонов ароматического цикла в области 6,87-6,93 дублет дублетов один протон, в области 7,29 дублет один протон, 7,40 дублет еще один протон. В спектре ЯМР 13C наблюдаем сигналы атомов углерода при 24,42 м.д. двух метильных групп, при 99,01 м.д. сигнал С-2 атома углерода, при 120,20, 126,79 и 127,87 м.д. сигналы атомов углерода ароматического цикла связанных с водородом, при 137,16 и 128,87 м.д. сигналы атомов углеродов связанные с атомами азота имидазольного цикла. Сигнал атома при 140,14 м.д. мы отнесли к углероду ароматического цикла связанному с нитрогруппой. Элементный анализ полученного соединения, соответствует брутто формуле C9H9N3O4. На основании этих данных, данному соединению приписали строение 2,2-диметил-4-нитро-2Н-бензимидазол-1,3-диоксида.
Заключительной стадией было изучение фотохромных свойств соединения.
Для изучения данных свойств мы нагревали полученное вещество в хлорбензоле до кипения (t=133 ºC) и затем кипятили, следя по ТСХ за ходом реакции в системе этилацетат-гексан. При нагревании мы наблюдаем, что в исходное вещество превращается с течением времени в два соединения, одно из которых бензоксодиазин, а второе моно-н-оксид. Превращение представлено на рисунке 2.
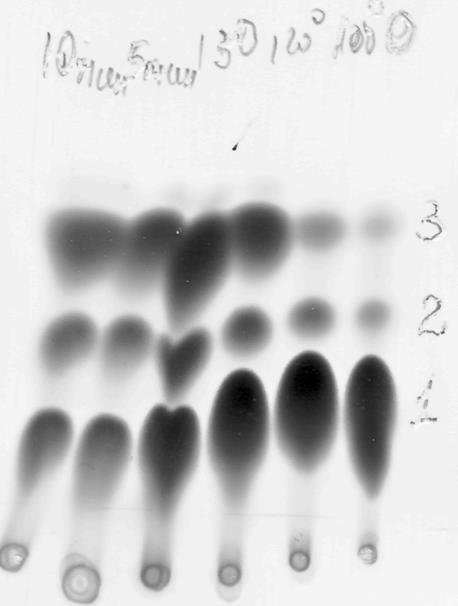
Рис 2. Хроматографическая пластинка.(Sorbfil)
1- исходное соединение, 2- моно-н-оксид, 3 - бензоксодиазин
Колоночной хроматографией на силикагеле с 70% выходом был выделен 8-нитро-3H-бензо-[с]-[1,2,5]-оксодиазин-4-оксид. При дальнейшем нагревании соединение разлагается по схеме приведенной ниже, механизм дальнейшего разложения неизвестен.
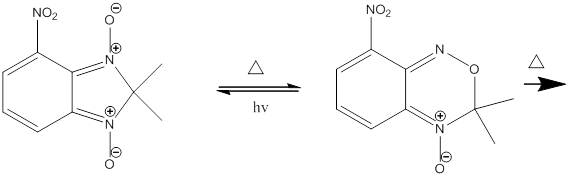
Заключение о строении данного вещества можно сделать, сославшись на следующие данные:
При нагревании соединения возможно образование 2х изомерных бензоксодиазинов. Однако для данной реакции мы наблюдаем образование только одного бензоксодиазина. Заключение о том, что именно это соединение получено в реакции, сделано на основании следующего:
Известно, что при нагревании 4-бром-6-нитро-спиро[бензимидазол-2,1-циклогексан]-1,3-диоксида образуется только один бензоксодиазин имеющий по данным РСА строение 8-Бром-6-нитроспиро[2,1,4-бензоксадиазин-
3,1'-циклогексан]-4-оксид, по аналогии с этими данными мы приписали строение полученному нами бензоксодиазину строение 8-нитро-3H-бензо-[с]-[1,2,5]-оксодиазин-4-оксид[15].
В ИК спектре соединения наблюдаются полосы поглощения при 1529 см -1,1344 относящие к валентным колебаниям нитрогруппы. В УФ спектре имеется полоса поглощения 404(3.30). В спектре ПМР наблюдается сигналы протонов двух метильных групп в виде синглета в области 1,61 м.д. наблюдаются сигналы протонов ароматического кольца в виде мультиплетов в области 7,42 - один протон, 7,53 м.д.- один протон и 6,73 один протон. В спектре ЯМР 13C имеются сигналы углерода при 19,90 м.д. двух метильных групп, 95,95 м.д. сигнал С-2 атома углерода, при 123,91, 124,43 и 128,31 м.д. сигналы атомов углерода ароматического цикла связанных с водородом, при 129,37 и 143,80, 143,18 м.д. сигналы атомов углеродов ароматического цикла.
Заключительной стадией было обратное превращение 8-нитро-3H-бензо-[с]-[1,2,5]-оксодиазина в 2,2,-диметил-4-нитро-2Н-бензимидазол-1,3-диоксид
Под действием солнечного света. Для этого мы растворили бензоксодиазин в хлороформе и оставили раствор на солнечном свете, раствор изменил цвет с красного на фиолетовый. По ТСХ в реакционной смеси наблюдается только один продукт – исходный 2,2,-диметил-4-нитро-2Н-бензимидазол-1,3-диоксид.
Таким образом мы синтезировали соединение 2,2,-диметил-4-нитро-2Н-бензимидазол-1,3-диоксид (фиолетовое), которое при нагревании изомеризуется в 8-нитро-3H-бензо-[с]-[1,2,5]-оксодиазина (красное), а в свою очередь под действием солнечного света наблюдается изомеризация 8-нитро-3H-бензо-[с]-[1,2,5]-оксодиазина (красное) в 2,2,-диметил-4-нитро-2Н-бензимидазол-1,3-диоксид (фиолетовое).






