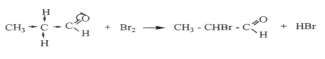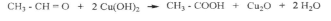Аминдер — молекуласындағы бір немесе бірнеше сутек атомы амин тобына (-NH2) алмасқан көмірсутектердіңтуындылары. Амин тобымен байланысқан радикалдың табиғатына байланысты аминдер алифатты және ароматтыболып бөлінеді.Аминдерді аммиактағы сутек атомдарының орнын радикал басқан аммиактың туындылары деп те қарастыруға болады.Молекуласындағы амин тобының санына байланысты аминдер: моноаминдер, диаминдер, полиаминдер болып бөлінеді. Атаулары мен изомерлеріХалықаралық (ИЮПАК) атау жүйесі бойынша көмірсутектерді нөмірлеп, көмірсутектердің атына амин, диамин немесе триамин деген сөз қосып атайды. Аминдерге көміртек қаңқасының және функционалдық топтың орнына байланысты изомерлену тән.[1] Алу жолдары
1. Аминдерді нитроқосылыстарды катализатор (Pt, Pd, Ni) қатысында тотықсыздандырып алады:
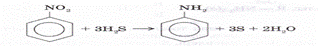
R – NO2 + 3H2 → R – NH2 + 2H2O
Өндірісте анилинді алу нитробензолды катализатор (Pd, Pt, Ni) қатысында тотықсыздандыруға негізделген:
C6H5NO2 + 3H2 → C6H5NH2 + 2Н2O
Н.Н. Зинин (1842 жылы) нитробензолды күкіртсутекпен тотықсыздандырып, анилин алған:
Нитробензолды шойын жоңқасы мен тұз қышқылы қатысында тотықсыздандырып та алады. Атом күйінде сутек бөлініп, ол нитробензолды тотықсыздандырады:[1]
Fе + 2HCl → FеСl2 + 2Н
C6H5 - NO2+ 6Н → C6H5 - NH2 + 2Н2O құрлысы: Аминдер қасиеттерінің аммиакқа үқсас болуы, олардың электрондық құрылысымен түсіндіріледі. Аммиак молекуласында азот атомының үш электроны ковалентті байланыс түзуге жұмсалады да, жұп электроны бос болады. Аминдер молекуласының құрылысы да аммиакқа ұқсас, азоттың үш электроны коваленттік байланыста болады, ал бір электрон жұбы бос болады:[1] 
Аминдердің химиялық қасиеттері
тұздар түзуі. Аминдер амиак сиақты минералды қышқылдармен тұздар түзеді
R2NH+HCI-NaOH-->R2NH*HCI-->R2NH+NaCI+H2O
Ацильдеу Ацильдеуші реагент ретінде хлор ангидридтер, ангидридтер, күрделі эфирлер қолданылады.Бұл реакцияға 1және 2-шілік аминдер түседі, ал 3-шілік аминдермен реакция жүрмейді.Реакция нәтижесінде амидтер түзіледі.
O O
ǁǁ ǁǁ
RNH2+CI-C-R/ -->R-NH-C-R + HCI
Тотықтырғыштардың әсері: 3-ік аминдер асқын қышқылдармен әсер еткенде 3-лік амидтердің N-оксидіне айналады.
(C2H5)3N-/O/-->(C2H5)3N--->O
№3
1. Алкандар — молекула құрамындағы көміртек атомдары өзара тек дара σ-байланыстар арқылы байланысқан жалпы формуласы CnH2n+2 болатын алифатты қаныққан көмірсутектер.
Алкандардың изомерлері мен атаулары
Изомерленудің бірнеше себебі болатынын өткен тақырыптардан білесіңдер. Алкандарға құрылымдық (көміртек қаңқасының) изомерлену тән. Ол молекуладағы көміртек атомдарының өзара орналасуынан болады. Тармақталмаған көміртек тізбегі нормалді изомер деп аталады.Алкандардың изомерленуі бутаннан (С4Н10) басталады. Бутанның молекуласында барлық көміртек атомдары тізбектеліп орналасады (н-бутан). Ал изобутанда көміртек атомдары тармақталып байланысады, негізгі көміртек тізбегі үш атомнан тұрады да, 4-көміртек атомы үзіліп, бүйірінен 2-көміртекпен байланысады.Тармақталған изомерлерде радикалдар әр түрлі орналасуы мүмкін.Қосылыс құрамындағы көміртек атомдарының сандары өскен сайын изомерлердің сандары да көбейе береді.Алкандардың бастапқы төрт көмірсутегі тривиальді аттармен аталады: метан, этан, пропан, бутан. Ал бесінші көмірсутек— пентаннан бастап грек сандарына -ан жұрнағы жалғанып аталады.Рационалды атау бойынша көмірсутектер бір немесе бірнеше сутек атомдары радикалдарға алмасқан метанның туындылары ретінде қарастырылады. Егерформулаларда бірдей радикалдар қайталанса, грекше ди-, три-, тетра-, т.б. сандармен көрсетіледі. Метан көміртегінің негізі етіп ең көп тармақталған көміртек атомы алынады.[1]
Көміртек атомдары басқа көміртектекдің әртүрлі сандарымен - 1,2,3,4мен байланыса алады соған байланысты С атомдары біріншілік,2,3,4лік болып бөлінеді. сол сияқты көміртек радикалдары да біріншілік,2,3лік болып бөлінеді.
2.Ннтроқосылыстардың химиялық қасиеті, ондағы нитро топтағы бес валентті азоттың табиғи ерекшелігіне байланысты. Нитроқосылыстардың классикалық формуласы төмендегідей өрнектеледі:
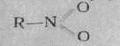
Құрамында қозғалғыш -жағдайдағы сутек бар біріншілік және екіншілік нитроқосылыстар оксоқосылыстармен қосылып, конденсациялану реакциясына түседі.

Нитроқосылыстар альдегидтер және кетондармен әрекеттескенде β-нитроспирттер құралады. Бұл рсакцияларда нитрокосылыс анионы карбений анионы іспеттес әрекеттеседі:
Нитрокосылыстар активтелген олефиндермен конденсацияланады. Оны Михаэл реакциясы деп те атайды. Мысалы, активтелген акрил қышқылының туындысын алайық:
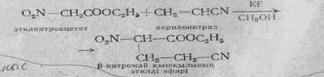
Нитрокосылыстардағы активті сутек атомы негіздердің қатысуымен галогендерде алмасады. Бұл реакция көмегімен біріншілік нитроқосылыстарды екіншіліктен айыруға болады.
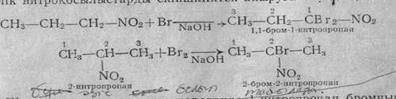
Жоғарыдаға теңдеулерге-қарағанда нитропропан бромның екі атомын, ал оның изомері 2-нитропропан бромның бір атомын қосады.
Нитротопқа 2-жағдайда орналасқан активті сутек атомы біріншілік нитроқосылыстарға азотты қышқылы әсер еткенде нитрозо топқа алмасып, нитрол қышқылдарын түзеді.
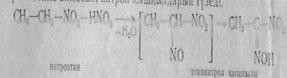 Ал екіншілік нитроқосылысты алсақ, мұндай реакция нәтжесінде псевдонитрол түзіледі:
Ал екіншілік нитроқосылысты алсақ, мұндай реакция нәтжесінде псевдонитрол түзіледі:
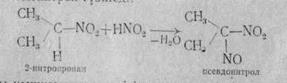
Азотты қышқылмен жүргізілген реакциялар біріншілік және екіншілік нитроқосылыстарды бір-бірінен ажыратуға көмектеседі. Нитроқосылыстардың маңызды реакцияларының қатарына оларды тотықсыздандыру реакциясы жатады. Бұл реакцияны жүргізу жағдайына байланысты әр түрлі азоторганикалық қосылыстар алуға болады.
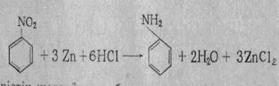
Нитротоптарды толық тотықсыздандыру оларды амин тобына айналдыруға мүмкіндік туғызады. Әсіресе, бұл реакция ароматты қосылыстар үшін маңызды. Онымен анилин және оның туындылары синтезделеді. Бұл реакцияны көрнекті орыс химигі Н. Н. Зинин ашқан: Өндірістік жағдайларда бұл реакция үшін мырыштың opна арзандау шойын ұнтағы (үгіндісі) қолданылады. Соңғы кезде бұл әдіс өзгеріп, никель, палладий немесе мыс сияқты катализаторлар көмегімен жүргізіледі.
№4 Органикалық қосылыстардың классификациясы:Органикалық қосылыстарды негізгі үш белгісі бойынша класстарға бөледі:1.С қанқасының құрылымы 2.Еселік байланыстардың бар жоғы 3.Функцияналдық топтардың түрлері.Ең негізгі белгі - С қаңқасының құрылымы.Ол былайша органикалық қосылыстарды 3 негізгі топқа бөледі.1.ациклді қосылыстар,яғни көміртек атомдары тұйықталмаған ашық тізбектер құрайды.2.карбоциклді қосылыстар,молекула құрамында тек көміртек атомдарынан құралған циклдар немесе сақиналар бар қосылыстар.Бұлардың өзі ациклді-циклогексан және ароматты-бензол болып бөлінеді.3.Гетероциклді қосылыстар,бұларға цикл құрамына көміртектен басқа элементтер О,S,N тб кіретін қосылыстар жатады.Еселік байланыстардың бар-жоғы бойынша органикалық қосылыстар қанныққан қанықпаған болып бөлінеді.Функцияналдық топтардың түріне қарай:1.спирттер OH фунц тобы 2.карбонильді қосылыстар >С=O ф.т.карбон қышқылдар -СООН ф.т. аминдер -NH2 ф.т болып бөлінеді.
Функцияналдық топ-органикалық қосылыстың осы классына жататының анықтайтын атомар немесе атомдар топтары.Бір молекуладан екіншісіне ауысатын көмірсутек бөліктерін радикалдар деп атап R деп белгілейді.Оргникалық радикалдар-бір немесе бірнеше сутек атомы үзілген көмірсутек молекуласының қалдығы.
2. Оксиқышқылдар деп, құрамында карбоксил топтарынан басқа бір немесе бірнеше гидроксил топтары бар органикалық карбон қышқылдарын айтады. Оксиқышқылдардың негізділігі карбоксил тобының санымен тағайындалады. Гидроксилдердің саны, оның ішіне карбоксил топтарының құрамындағы гидроксилдері бар, оксиқышқылдардың атомдылығын тағайындайды. Мысалы, сүт қышқылы СН3—СНОН—СООН — бір негізді екі атомды қышқыл, алма қышқылы НОСО—СНОН—СН2— СООН — екі негізді үш атомды, шарап қышқылы НОСО— СНОН—СНОН—СООН — екі негізді төрт атомды.Оксиқышқылдар аттарын көбінесе, өздеріне сәйкес карбон қышқылдарының окситуындылары ретінде алады. Сонда, гидроксил және карбоксил топтарының орналасу орындары грек алфавитінің әріптерімен көрсетіледі, мысалы, а-оксипропион СН3—СНОН—СООН, β-оксипропион НОСН2—СН2—СООН. Систематикалық номенклатура бойынша оксиқышқылдардың аттары карбон қышқылдарының аттарынан шығарылады сөйтіп, сол аттың басына спирттерге тән окси деген сөз қосылады (гидрокси). Нөмірлеу әдетте карбоксил тобынан басталады. Мысалы, сүт қышқылын 2-оксипропан қышқылы деп атауға да болады.
. Алу әдістері. Оксиқышқылдарды құрамына гидроксил тобын енгізіп, қышқылдардан немесе құрамына карбоксил тобын енгізіп, спирттерден алуға болады. 1. Оксиқышқылдарды галогеналмасқан қышқылдарды гидролздендіріп алу. Бұл әдіс әсіресе -оксиқышқылдарды синтездеу үшін қолайлы: -галогеналмасқан қышқылдар карбон қышқылдарын галогендендірсе оңай алынады, суға араластырып қыздырғанның өзінде ешқандай қосалқы процессіз-ақ қышқылдың галогені судың гидроксилімен оңай алмасады:
СН3—CHC1—СООН+НОН↔ СН3—СНОН—СООН+НСl
Алкоголяттармен -галогеналмасқан қышқылдардың эфирлеріне әрекет жасап оксиқышқылдардың жай эфирлері алынады.
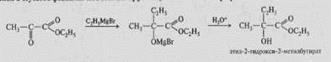
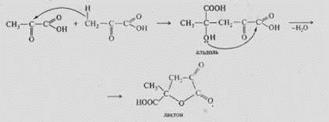
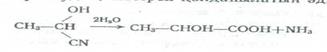
2.Оксинитрилдердің сабындануы. Оксинитрилдердің гидролизі -оксиқышқылдар береді. Бұл -оксиқышқылдар алудың көбірек қолданылатын әдістерінің бірі:
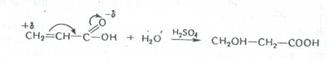
4. Қанықпаған қышқылдарға судың қосылуы. Акрил қышқылы, мысалы, H2SO4 барында су қосып алып β-оксипропион (гидракрил) қышқылын түзеді.
1.1.3.Химиялық қасиеттері.
1. а-Оксиқышқылдар карбон қышқылдарына айналып оңай тотықсызданады, мысалы иодты сутекпен әрекеттестіргенде:
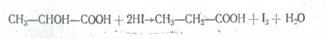
2.Сұйытылған қышқылдармен араластырып қайнатса α-оксиқышқылдар ыдырап құмырсқа қышқылын бөліп шығарады:
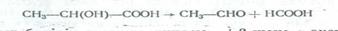 3. Қыздырғанда α-оксиқышқылдар су бөліп шығарып цикльді күрделі эфирлер лактидтер түзеді.
3. Қыздырғанда α-оксиқышқылдар су бөліп шығарып цикльді күрделі эфирлер лактидтер түзеді.
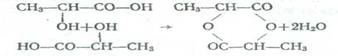
4. β-Оксиқышқылдар судың элементтерінен айырылып қанықпаған қышқылдар береді. Сусызданудың ол бағыты карбоксил тобына көрші орналасқан сутек атомдарының көтеріңкі қозғалмалы болуына байланысты:
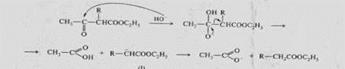
№5 1.Электртерістігі жоғары атомның коваленті байланыстың сигма электрон жұбын өзіне қарай ығыстыру қабілеті индуктивті эффект деп аталады. Индуктивті эффект он және теріс болады.егер атом електрон жұбын өзінен кері ығыстыратын болса ол он индуктивті эффект деп аталады. +Lдеп белгіленеді.мұнын нәтижесінде атом өзі ішнара оң зарядқа ал көрші атом ішінара теріс зарядқа ие болады. керсінеше атом немесе радикал сигма электрон жұбын өзіне тартып, көрші атомның электрон тығыздығын томендетсе ол теріс индуктивті эффект деп аталады және -L эффект деп белгіленеді. Мұнын нәтижесінде ватом ішінра теріс зарядқа ал көрші атом ішінара он зарядқа ие болады. Қанықпағакн қосылыстарда әсіре қосаврланған қос байланысы бар немесе ароматты қосылыстарда электрон ығысуы өзгеше болады. мұндай электрон донорлы және акцепторлы қосылыстарда пи электрон бұлты ығысады.онын нәтижесінде қос байланысты жүйенің бір ұшында он келесі ұшында теріс заряд пайда болады.қос байланысты және ароматты қосылыстарда байқалатынт бұл құбылыс мезомерлі эффект деп аталады.
2.алкандардың химиялық қасиеттері
Алкандар орынбасу, айырылу изомерлену және тотығу реакцияларына түседі. Алкандардың басқа көмірсутектермен салыстырғандағы бір ерекшелігі — олардың құрамындағы көміртек атомдарының валенттіктері толығымен сутек атомдарымен қаныққан. Сондықтан алкандар қосылу реакцияларына түспейді.Алкандар құрамындағы тағы бір ерекшелік — оларда едәуір берік коваленттік σ-байланыстың болуы. Бұл байланыстың полюстігі төмен, сондықтан алкандар, негізінен, SRмеханизмі бойынша реакцияларға түседі. С—С байланыс едәуір қатаң жағдайда үзіліп, реакцияға қиын түседі. Алкандардың парафиндер деп аталу себебі осы.Алкандар химиялық реакцияларға энергия берген (қыздыру немесе ультракүлгін сәулелердің әсерінен) жағдайда ғана түседі. Реакция барысында көміртек пен сутек С—Н арасындағы байланыс үзіліп, сутек атомы басқа атомдар мен атом топтарына алмасады немесе көміртек атомдарының С—С араларындағы байланыстар үзіледі. Алкандар полюссіз қосылыстар болғандықтан, байланыстардың үзілуі негізінен радикалдар түзе, гомолиттік механизм бойынша жүреді.1. Галогендену реакциялары — алкандардың практикалық маңызды реакцияларының бірі, жарықтың немесе жоғары температураның әсерінен іске асады. Жарықтыңәсерінен жүретін реакциялар фотохимиялық реакциялар деп аталады. Алкандардың галогендермен орынбасу реакциялары хлормен жеңіл, броммен қиындау, йодпенқиын жүреді. Ал фтормен қопарылыс түзе жүретін болғандықтан, реакцияны инертті газ қатысында сұйылтып жүргізеді. Сутектердің орнын галогендерге алмастырғанда, алкандардыц галогентуыидылары түзіледі.Метанның хлорлану реакциясы жарықтың ([hν—"аш ню" арқылы жарық кванты белгіленеді) немесе температураның әсерінен жүреді. Реакция метанның хлортуындылары мен хлорсутек түзе жүреді:
СН4 + Сl2 → СН3Сl +HCl
CH3Cl + Cl2 → CH2Cl2+ HCl
CH2Cl2 + Cl2 → CHCl3 +HCl
СНСl3 + Сl2 → ССl4 + HCl
Айырылу (ыдырау)реакциялары қыздырғанда жүреді. Метанды бұдан да жоғарырақ температурада қыздырғанда (1500°С), реакция қанықпаған көмірсутек — ацетилен түзе және сутек бөле жүреді: 2СН4 → НС = СН + ЗН2 Алкандар 500°С-тан жоғары температурада көміртек атомдары арасындағы С—С байланыстары үзіле айырылады. Нәтижесінде, құрамы қарапайымдау, көміртек атомдарының сандары азырақ көмірсутектер (қаныққан немесе қанықпаған) түзіледі. Бұл процесс крекинг деп аталады. Изомерлену реакциялары барысында С—С байланыстары үзіліп, түзу көміртек тізбегі тармақталғанға айналады.Изомерлену процесі өршіткі (АlСl3) қатысында және қыздырғанда (-400 °С) жүреді. Тотығу реакциялары СН4 + 2O2 → СO2 + 2Н2O ΔН =-890 кДж/моль
№6 Алкадиендер — қанықпаған көмірсутектердің маңызды түрлерінің бірі.Алкадиендер - құрамында екі қос байланысы бар, жалпы формуласы СnН2n-2 болатын қанықпаған көмірсутектер.Алкадиендерді кысқартып диен көмірсутектері деп те атайды. Қос байланыстың орналасуына боиынша диендер былай бөлінеді:1.қщс баиланыстар көрші орналасқан диендер-аллендік немесе кумулденген қос байланысты диендер.мыс.аллен.2.Қос баиланыстар бир жай баиланыспен бөлінген яғни 1,3 орындарда қос баиланысы бар диендер қосарланған қос баиланысты диендер деп аталады.3.қос баиланыстар 2 немесе одан да көп жаи баиланыстар арқылы бөлінген диендер оқшауланған диендер деп аталады.Диен көмірсутектерінің изомериясы 2 факторға баиланысты:1.көміртек қаңқасыныі құрылымы 2.қос баиланыстың орны ИЮПАК номенклатурасы боынша 2 немесе оданда көп қос баиланыстың болуы дие,триен тб жұрнақтарымен белгіленеді.Барлық қос баиланыстардың орындары ең аз номірге ие болатындаи етіп номірлейді.Сонымен қатар кең таралған диендердің тривиалды аттары да бар,мыс,дивинил.изопрен. Алкадиендердің құрылысын бутадиен-1,3-тің мысалында қарастырайық. Зерттеулердің нәтижесінде, бутадиен-1,3-тің молекуласындағы барлық атомдардың бір жазықтықта жататыны белгілі болды. С1 мен С2 және С3 пен С4 көміртектердің арасындағы қос байланыстар этиленнің қос байланысынан (0,134 нм) гөрі ұзындау (0,136 нм), ал ортадағы дара байланыстың ұзындығы алкандардың дара байланысынан (0,154 нм) гөрі қысқалау (0,146 нм) болатыны анықталды.
2. Этиленнің (этеннің) С2Н4 құрамында бір қос байланыс бар. Этиленнің құрылымдық формуласы: СН2 = СН2.Этилен молекуласында әр көміртек атомы екі сутек атомдарымен дара байланыстармен байланысады және өзара қос байланыс арқылы жалғасады. Этиленді алу. Химиялық белсенді болғандықтан қанықпаған көмірсутектер таза күйінде табиғатта өте сирек кездеседі. Этилен қатарының көмірсутектерін жоғары температурада сутек бөле отырып, алкандарды айыру арқылы алады. Мысалы, этаннан этилен алуды қарастырайық: С2Н6 → С2Н4 + Н2 Физикалық қасиеттері. Этилен — түссіз, иісі жоққа тән, ауадан аздап жеңілдеу, суда нашар еритін, жанғыш газ. Химиялық қасиеттері 1. Этилен ауада жарқыраған жалын шығарып жанады: С2Н4 + 3О2 → 2СО3 + 2Н2О
2. қосылу реакциялары тән. а) Өршіткі (никель, платина) қатысында этилен сутекті қосып алып этанға айналады: Немесе осы реакцияны ықшамдап жазсақ:С2Н4 + Н2 → С2Н6 ә) Этилен галогендерді қосып алады. Ол броммен әрекеттескенде бромның қызыл қоңыр түсі жойылып, түссіз дибромэтан түзіледі:
СН2 = СН2 + Вr2 → ВrСН2 — СН2Вr немесе С2Н4 + Вr2 → С2Н4Вr2 (дибромэтан) Бұл этиленнің сапалық реакциясы, бромның түссізденуі бойынша этиленнің бар-жоғын анықтауға болады. б) Этилен қос байланыс арқылы су молекуласын қосып алып, этил спиртін түзеді: Н2С = СН2 + Н—ОН → Н3С — СН2ОН немесе С2Н5ОН Бұл реакцияның өнеркәсіптік маңызы зор. Қазақстанда Шымкент пен Атырау химия зауыттарында осы реакция бойынша этиленнен этил спирті алынады. 3. Этилен полимерлену реакциясына түседі. Молекула құрамындағы қос байланыстың біреуінің үзілуі нәтижесінде этилен молекулалары өзара тізбектеліп қосылып, полиэтилен түзеді: n СН2 = CH2 (-СН2 - СН2 -) n Этилен мен оның туындыларының қолданылуы Этиленнің жеміс-жидектердің пісуін тездететін ерекше қасиеті бар.Этиленнен тұрмыс пен техникаға аса қажетті полиэтилен, этил спирті, хлорэтан, дихлорэтан, т.б. заттар алынады.Полиэтилен — диэлектрик, сондықтан оқшаулағыш материал ретінде электротехникада қолданылады. Су мен газды өткізбейтін болғандықтан, полиэтилен тағамдық, өнімдер мен әр түрлі бұйымдарды орап сақтауға және үлпек қабыршықтар мен құбырлар жасауда қолданылады. Сонымен қатар жылыжайлар мен саяжайларда шынының орнына кеңінен пайдаланылады.
№7 Спирттер (ағыл. spіrіt) – құрамында бір не бірнеше гидроксил топтары – (–ОН) болатын көмірсутек туындылары. Гидроксил. тобының санына қарай бір, екі, үш, төрт және көп атомы. Женева номенклатурасы бойынша көмірсутек атына “ол” жұрнағын жалғайды (мысалы, этанол, бутанол, диол, триол, т.б.). Кейде ОН тобының орнын көрсетіп атайды (мысалы, пропанол-2, пропандиол-1, 3), бұдан басқа спирттердің тарихи қалыптасқан атаулары да қолданылады (мысалы, этил спиртін – шарап спирті, метил спиртін – ағаш спирті деп атайды). Бір атомды алифатты спирттер улы (мысалы, метанол – жүйке және тамырға қоздырғыш әсер етеді, этанол – сұйық есірткі, ұзақ әсер еткенде жүйке, ас қорыту, қан тамыр, бауыр, т.б. ауруларын тудырады).
спирттердін изомериясы 2 факторға байланысты:1.С қанқасының құрлымы 2.ОН тобынын орны.
2 

№8 Орынбасу реакциясы. Орын басу реакциясы дегеніміз (S) молекула құрамындағы атомдық топтардың басқа молекула құрамындағы атомдық топтармен алмасуы.R-СН3 + С12 → R-СН2С1 + НСІ — хлорлау реакциясы R-СН2СІ + AgNO3 → R-СН2NO2 + AgСІ↓-нитрлеу
Қосылу реакциясы дегеніміз (А) қанықпаған молекуладағы π-байланысы үзіліп, екі атом немесе екі атом тобының қосылуы. Байланыстың үзілуі гомолитикалық та, гетеролитикалықта жолмен жүруі мүмкін, демек қосылу реакциялары әрі радикалдық, әрі иондық сипатта болады.
СН2= СН2 + Н2 →СН3 - СН3 гидрогендеу реакциясы R-CH=CH2 + HBr → R-СHBr-CH3 гидрогалагендеу
Айырылу реакциясы дегеніміз (Е элиминирование) молекула кұрамынан жай не күрделі заттың бөлініп шығуы. Бұл реакциялар көбінесе гетеролитикалық жолмен жүреді.
Қарастырылған үш типтен басқа органикалық химияда тотығу, тотықсыздану және қайта тотықтану реакциялары жүреді. Тотығу молекуланың тікелей отегімен әрекеттесуі, немесетотықтырғыш әсерінен сутегін жоғалту.
Тотықсыздану молекуланың сутекті қосып алуы немесе оттегіні беліп шығаруы.
R – CHO + H2 → R-CH2OH R-CH2NO2 + 3H2 → R-CH2NH2 + 2H2O
Қайта топтану реакцияларына барлық изомерлену реакциялары жатады. Молекуланың құрам бөліктерінің байланысу тәртібіңің езгеруіне немесе олардың кеңістікте орналасутәртібінің өзгеруінен болатын реакциялар, реакцияға түскен зат пен реакциядан шыққан зат құрамы бірдей болады.
СН3- СН2-СН=СН2 ↔ СН3-СН=СН-СН3
Бутен-1 Бутен-2
Кейде бір изомердің екіншіге айналуы тек бір атомның орнын ауыстыру арқылы болады, мұндай құбылысты таутомерия деп атайды.
2. Көпатомды спирттер. Көп атомды спирттер көмірсутектердің құрамында бірнеше гидроксил тобы бар туындылары. Көпатомды спирттерге этиленгликоль С2Н44(ОН)2, глицерин С3Н5(ОН)3, ксилит С5Н7(ОН)5, сорбит С6Н8(ОН)6, т.б. жатады. Екі гидроксил тобы бар спирттерді гликолъдер немесе алкандиолдар деп атайды. Жалпы формуласы: СnН2n(ОН)2. Аталуы. Халықаралық атаулар жүйесі бойынша сәйкес қаныққан көмірсутек атына диол немесе триол жұрнағын қосып, гидроксил тобы байланысып тұрған көміртекатомының нөмірі көрсетіледі.
Глицерин СН2ОН — СНОН — СН2ОН — тәтті дәмі бар түссіз, қоймалжың сұйықтық. Суды жақсы сіңіретін, гигроскопиялық зат. Көп мөлшерде химия және тамақ өнеркәсібінде қолданылады. Глицерин гигроскопиялық зат болғандықтан, теріні жұмсартатын қасиетіне байланысты парфюмерияда, былғары өнеркәсібінде пайдаланады. Сонымен қатар глицерин қопарылғыш заттар және дәрі-дәрмектер өндіруде медицинада қолданылады. Дикарбон қышқылдары және олардың туындыларымен глицеринді әрекеттестіріп, полимерлі қосылыс — полиэфир алады. этиленгликоль СН2ОН - СН2ОН және глицерин СН2ОН - СНОН - СН2ОН. Олардың құрамында гидроксил тобы болғандықтан, қасиеттері біратомды спирттерге ұқсас. Айырмашылығы — гидроксил тобының санына байланысты. Этиленгликоль синтездік талшық алу үшін және антифриз ретінде қолданылады. Глицерин былғары өнеркәсібінде, дәрі-дәрмек, қопарылғыш зат алуға, т.б. қолданылады[1]
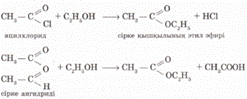
№9 Жай эфирлер молекуласындағы екі көмірсутек радикалы оттек атомы арқылы байланысқан қосылыстар. Жай эфирлердің жалпы формуласы: R — О — R'. Алу тәсілдері Жай эфирлер табиғатта кездеспейді, оларды синтездік жолдармен алады.1.Минерал қышқылы қатысында спирттерді молекулааралық дегидратациялап алады:С2Н5ОН + НОС2Н5 → С2Н5 - О - С2Н5 (диэтил эфирі).2.Алкоголяттарды галогеналкилдермен әрекеттестіріп алады:C2H5ONa + СН3І → С2Н5 - О - СН3 + Nal (метилэтил эфирі). Күрделі эфирлер табиғатта кең тараған. Олар биологиялық өте маңызды қосылыстар. Гүлдер мен жемістердің құрамында күрделі эфирлер болуына байланысты олардың хош иістері болады. Өсімдік және жануарлар майлары күрделі эфирлерге жатады
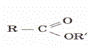 Күрделі эфирлер кіші және үлкен молекулалы, қаныққан, қанықпаған, ароматты қышқылдар мен спирттерден түзілуі мүмкін. Күрделі эфирлерді спирттер мен бейорганикалық қышқылдарды әрекеттестіріп те алады. Алу әдістері 1.Күрделі эфирлер көбіне табиғи өнімдерден алынады. 2.Этерификация реакциясында карбон қышқылдары мен спирттерді минерал қышқылдар қатысында әрекеттестіріп, нәтижесінде, күрделі эфир мен су түзіледі 3.Күрделі эфирлерді қышқылдың галогенангидридтерін және ангидридтерін спирттермен әрекеттестіріп алады. Мысалы:
Күрделі эфирлер кіші және үлкен молекулалы, қаныққан, қанықпаған, ароматты қышқылдар мен спирттерден түзілуі мүмкін. Күрделі эфирлерді спирттер мен бейорганикалық қышқылдарды әрекеттестіріп те алады. Алу әдістері 1.Күрделі эфирлер көбіне табиғи өнімдерден алынады. 2.Этерификация реакциясында карбон қышқылдары мен спирттерді минерал қышқылдар қатысында әрекеттестіріп, нәтижесінде, күрделі эфир мен су түзіледі 3.Күрделі эфирлерді қышқылдың галогенангидридтерін және ангидридтерін спирттермен әрекеттестіріп алады. Мысалы:
2. Химиялық қасиеттері.Этилен мен оның гомологтары қосылу, полимерлену және тотығу реакцияларына түседі.Қосылу реакциялары1. Гидрленуі (сутектің қосылуы). Алкендер сутекті қосып алып, сәйкес алкандарға айналады. Реакция металл катализаторлар Ni, Pt, Pd қатысында жүреді. Мысалы, пропенге сутек косылғанда, пропан түзіледі: CH3—CH = CH2 + H — H → CH3 — CH2 — CH3 2. Галогенденуі (галогендердің қосылуы). Алкендер галогендермен әрекеттескенде, реакция қос байланыс бойынша жүріп, нәтижесінде, алкандардың дигалогентуындылары түзіледі. Реакция алкенді галогеннің ерітіндісімен кәдімгі температурада әрекеттестіргенде жүреді. Алкендерді бромды сумен (бромның судағы ерітіндісі) әрекеттестіргенде, ерітіндідегі бромның қызыл қоңыр түсі жойылып, түссіз дибромалкандар (СnН2nВг2) түзіледі: Н2С = СН2 + Вг2 → ВгН2С - СН2Вr Бромдау реакциясы алкендердің сапалық реакциясы болып табылады, бромның түссізденуі бойынша алкендерді сапальщ анықтауға болады. 3. Галогенсутпектперді қосу. Алкендерге галогенсутектердің қосылуы оңай жүріп, нәтижесінде, галогеналкандар түзіледі: H2C = CH2 + Н - Сl → H3C - СН2Сl Галогенсутектердің симметриялы емес алкендерге қосылу реакциялары В. В. Марковников ережесі бойынша жүреді. Галогенсутектің сутек атомы сутек көп көміртекатомына, ал галоген сутек аз көміртпек атомына қосылады: H2С = СН3 - СН + Н - Вг → Н3C - СНВг - CH3 Тотығу реакциялары. Алкендер алкандармен салыстырғанда оңай тотығады. 4. Алкендердің қалыпты жағдайда тотығуы. Этиленді калий перманганатының ерітіндісі арқылы өткізсе, оның күлгін түсі жойылып кетеді. Бұл перманганаттың этиленді тотықтыратындығын көрсетеді. Реакция нәтижесінде екіатомды спирт — этиленгликоль түзіледі. 5.Қатаң жағдайларда тотықтырғанда (күкірт қышқылы, перманганат немесе хром қоспасы катысында) алкен молекуласының қос байланысы үзіліп, оттекті органикалыққосылыстар түзіледі: HC3 - CH=CH - CH3 + /O/ → 2CH3 - COOH
№10 1. электрон тартқыштық қабілеті жоғары қосылыстар молекуланың электрон тығыздығы жоғары атомдарына женіл қосады.мұндай әрекеттесетін реагенттер электофилдер деп аталады. бұлардын қатысуымен жүретін реакциялар электрофилді реакциялар деп аталады. электрофилді орынбасу реакциясы Se деп белгіленеді. химиялық реакцияларда электрофилдер электорн акцепторлар болып табыладыв. және элетрондарды қабылдайды. электрофилдер катиондар карбакатиондар және бос электрон орбиталы бар қосылыстар болып келеді. Атом ядросына немесе электрон тығыздығы төмен атомдарға тартылу қабілеті күшті реагенттер нукляфилдер деп аталады. бұлардын қатысуымен жүретін реакциялар нуклеофилді реакциялар деп аталады.нукляофилді орынбасу реакциясы SN белгіленеді. Әдетте нукляофилдер теріс зарядты аниондар болып келеді.олардын бөлінбеген электрон жұптары р-электрон немесе пи байланыстары болады. химиялық реакцияларда нуклеофилдер өз электрондарын атом ядросына береді немесе бөліседі, сондықтан электрон тығыздығы ен төмен атомдармен әрекеттеседі.олар электрон донорлары.
2.