Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит как внутримолекулярная или межмолекулярная реакция.
1. Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140 °С.
Например:

В тех случаях, когда возможны 2 направления реакции, например:

дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
2. Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с образованием простых эфиров:

Этиленгликоль представляет собой гигроскопичную бесцветную жидкость, почти без запаха, имеющую температуру кипения 197˚С и смешивающуюся с водой во всех отношениях. Чаще всего этиленгликоль используется при получении полиэфирного связующего, применяемого в производстве листового стеклопластика.
Глицерин представляет собой вязкую гигроскопичную бесцветную жидкость, не имеющую запаха и обладающую сладким вкусом. Он смешивается с водой во всех отношениях и является хорошим растворителем спиртов, этиленгликоля, пропиленгликоля, аминов и многих органических и неорганических солей. Глицерин используется в основном при производстве насыщенных полиэфирных смол.
Этиленгликоль и глицерин подобны одноатомным спиртам. Они реагируют с активными металлами.
Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:

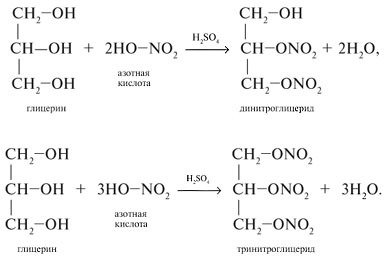

Применение:
Глицерин – в парфюмерии, косметике, медицине – растворитель, компонент мазей;
для производства тринитроглицерина
Этиленгликоль (ЭГ) – в антифризах, 66%-й ЭГ замерзает при –60 °C; в синтезе лавсана [–СН2СН2О (О) СС (О) O–]n;
растворитель (tкип = 198 °С).
Глико́ли (дио́лы, двухатомные спирты) — класс органических соединений, содержащих в молекуле две гидроксильные группы. Имеют общую формулу CnH2n(OH)2. Простейшим гликолем является этиленгликоль НО-СН2-СН2-ОН.
В промышленности диоксан получают из этиленгликоля, из хлорекса и окиси этилена:

Молекула центросимметрична и принимает пространственную конформацию «кресла», типичную для производныхциклогексана. Молекула конформационно подвижная и может также легко принять конформацию «ванны», необходимую для хелатирования катионов металлов.
В 1985 мировое производство диоксана составляло 11-14 тысяч тонн
Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.






